Elektrony w atomie
Czy elektrony w atomie mogą poruszać się w dowolnej przestrzeni wokół jądra? Czy natura dopuszcza możliwość zderzenia się elektronów w atomie?
że elementami tworzącymi atom są: elektrony, protony, neutrony;
że centralną część atomu (jądro atomowe) tworzą nukleony (protony i neutrony);
że elektrony znajdują się w przestrzeni wokół jądra atomowego;
że w atomie liczba protonów jest równa liczbie elektronów.
oznaczać powłoki elektronowe w atomie;
określać maksymalną liczbę elektronów tworzących poszczególne powłoki elektronowe atomu;
opisywać rozmieszczenie elektronów w atomie;
wskazywać elektrony walencyjne.
1. Czy elektrony w atomie poruszają się w dowolnym miejscu przestrzeni wokółjądrowej?
Elektrony zajmują w atomie przestrzeń wokół jądra. Poruszają się w niej z dużą szybkością i w różnych kierunkach. Mówi się o nich, że tworzą chmurę elektronową.
Przestrzeń w atomie zajmowana przez elektrony jest ogromna w stosunku do objętości, jaką zajmuje jądro atomowe. Jednak nie oznacza to, że każdy z elektronów porusza się swobodnie w każdym punkcie tej przestrzeni. Okazuje się bowiem, że elektrony poruszają się tylko w ograniczonych obszarach. Obszary te nazwane zostały powłokami elektronowymi. W ich obrębie elektrony poruszają się z dużą szybkością i we wszystkich kierunkach. Liczba powłok elektronowych w atomach jest różna i uzależniona od liczby elektronów. Największe znane nam atomy mają siedem powłok, a najmniejsze – jedną.
Elektrony poruszające się na różnych powłokach różnią się energią. Im bliżej jądra atomowego znajduje się elektron, tym ma niższą energię. I przeciwnie – im dalej od jądra atomowego znajduje się elektron, tym jego energia jest wyższa.

Film dostępny na portalu epodreczniki.pl
Film zaczyna się od ujęcia przestrzeni wypełnionej szczelnie szarymi kulkami symbolizującymi atomy. Następuje zbliżenie na jedną z takich kulek. Kulka zamienia się na schemat atomu z czarnym jądrem i szarą przestrzenią wokół niego, która na krawędzi przechodzi w biel. Pojawia się animacja strzałki okrążającej szarą przestrzeń zgodnie z ruchem wskazówek zegara. Strzałka ta odsłania spod szarej zasłony obraz czerwonej kuli w środku oznaczonej jako jądro i naprzemienne otaczające ją białe i szare pierścienie oznaczone jako powłoki elektronowe. Następuje oddalenie od atomu i zaznaczenie siedmiu szarych, ale coraz jaśniejszych wraz ze wzrostem liczby powłok elektronowych. Pierścień, czyli powłoka numer 1 jest najbliżej jądra, a powłoka numer 7 najdalej. Ponowne zbliżenie na jądro atomu, tym razem widoczne są cztery powłoki elektronowe. Do każdej z nich prowadzi strzałka podpisana tekstem Elektrony o podobnej energii. Cały schemat nosi podpis Energia elektronu. Podpis znika, a pomiędzy powłokami pojawiają się małe czerwone znaki nierówności skierowane czubkiem do wnętrza atomu. Następuje oddalenie widoku połączone z zaznaczeniem wszystkich siedmiu powłok elektronowych. Pojawia się gruba czerwona strzałka skierowana od jądra atomu w kierunku zewnętrznym i podpisana Energia elektronu rośnie.
Powłoki elektronowe nie mają fizycznego odzwierciedlenia w budowie atomu. To przede wszystkim energia danego elektronu oraz obecność pozostałych elektronów decydują, w jakim obszarze wokół jądra będzie się on poruszał. W przestrzeni wokół jądra nie ma żadnych fizycznych barier, które utrzymywałyby elektron na określonej powłoce.
2. Ile elektronów może znajdować się na powłokach?
Powłokom elektronowym w atomie nadano symbole literowe od K do Q. Powłoka najbliżej jądra (pierwsza) oznaczona jest literą K. Następne to: L, M, N, O, P, Q.
Kolejność powłok (odległość od jądra) | pierwsza | druga | trzecia | czwarta | piąta | szósta | siódma |
Symbol powłoki | K | L | M | N | O | P | Q |
Na każdej z powłok może znajdować się określona liczba elektronów. Na przykład na pierwszej powłoce mogą przebywać tylko dwa elektrony, a na trzeciej – osiemnaście. Im dalej od jądra atomu znajduje się powłoka, tym więcej elektronów może pomieścić. Maksymalną liczbę elektronów, jaka może znajdować się na powłoce, opisuje wzór: 2n Indeks górny 22, w którym n oznacza numer powłoki.
Numer powłoki (n) | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Symbol powłoki elektronowej | K | L | M | N | O | P | Q |
Maksymalna liczba elektronów na powłoce (2nIndeks górny 22) | 2 | 8 | 18 | 32 | 50 | 72 | 98 |

3. Jak rozmieszczone są elektrony w atomie?
Rozmieszczenie elektronów na poszczególnych powłokach nazywa się konfiguracją elektronowąkonfiguracją elektronową. Jej zapis poznamy na przykładach. Przedstawienie konfiguracji elektronowej atomu rozpoczniemy od atomu helu, który ma dwa elektrony. Te dwa elektrony mogą przebywać na pierwszej powłoce K. Tę informację możemy zaprezentować na kilka sposobów. Przedstawiono je w tabeli 3.
Sposób prezentacji | Konfiguracja elektronowa | Ogólne zasady zapisu |
zapis z użyciem nawiasów kwadratowych | [2] | W nawiasie kwadratowym wymieniamy kolejno liczby elektronów znajdujących się na powłokach: pierwszej, drugiej i kolejnych. Liczby te oddzielamy przecinkami. |
zapis z użyciem symboli powłok | KIndeks górny 22 | Podajemy symbole zajętych przez elektrony powłok. Z prawej strony każdego symbolu, w indeksie górnym, zapisujemy liczbę elektronów znajdujących się na powłoce. |
Zapis w postaci schematu
Rysujemy schemat, na którym zaznaczamy jądro atomu i kolejne zapełnione przez elektrony powłoki. Wpisujemy symbole powłok i liczby przypisanych im elektronów.
Zastanów się i odpowiedz, która z liczb: atomowa czy masowa jest niezbędna do określenia konfiguracji elektronowej atomu?
Zauważ, że do przedstawienia konfiguracji elektronowej atomu konieczna jest znajomość liczby elektronów. A jak pamiętamy, liczba elektronów jest równa liczbie protonów.

Film dostępny na portalu epodreczniki.pl
Konfiguracja elektronowa atomu tlenu
Konfiguracja elektronowa atomu krzemu
Zapis z użyciem nawiasów kwadratowych
[2,8,4]
Zapis z użyciem symboli powłok
K Indeks górny 22L Indeks górny 88M Indeks górny 44
Zapis w postaci schematu

Zapełnianie powłok 2. (L) i 3. (M) w atomach następuje, gdy niższa powłoka zostanie zapełniona maksymalną liczbą elektronów. W przypadku atomów o liczbie atomowej większej niż 18 reguła ta zazwyczaj nie obowiązuje. Choć na powłoce trzeciej może znaleźć się maksymalnie 18 elektronów, to obsadzanie czwartej powłoki następuje często zanim powłoka trzecia całkowicie się wypełni.
Zjawisko to obrazują prawidłowo zapisane konfiguracje elektronowe, m.in. następujących atomów pierwiastków chemicznych:
[2, 8, 8, 1]
[2, 8, 8, 2]
[2, 8, 9, 2]
4. Czy elektrony ostatniej powłoki są ważne?
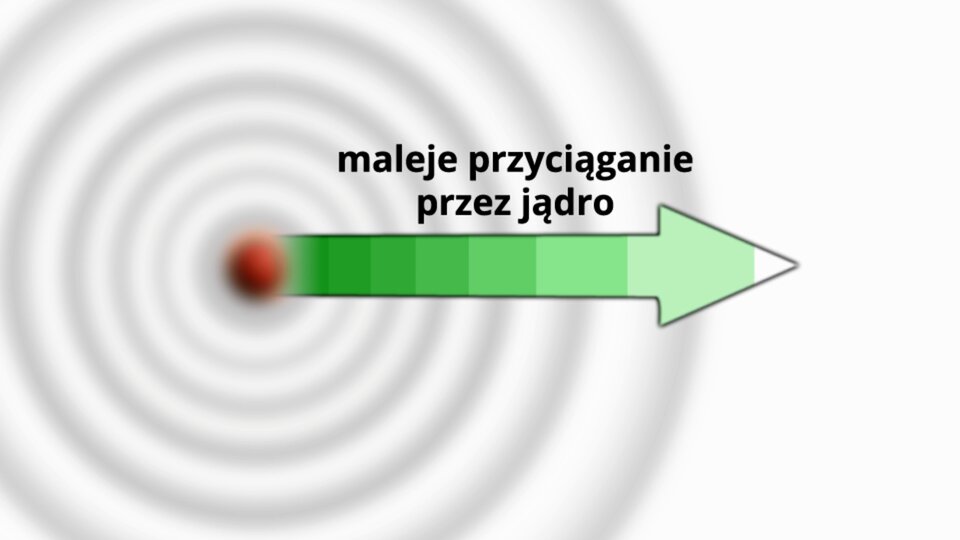
Elektrony znajdujące się najdalej od jądra atomowego są najsłabiej przez to jądro przyciągane i często oddziałują na elektrony innych atomów. Można o nich w przenośni powiedzieć, że reprezentują atom na zewnątrz. Decydują o właściwościach atomu. Jako jedyne ze wszystkich mają własną nazwę – elektrony walencyjneelektrony walencyjne, a powłoka, na której się znajdują, nazywa się powłoką walencyjnąpowłoką walencyjną. Atomy mogą mieć różną liczbę elektronów walencyjnych (od jednego do ośmiu).
Film dostępny na portalu epodreczniki.pl
Elektrony walencyjne
Atomy | Konfiguracja | Liczba elektronów |
KIndeks górny 11 | 1 | |
KIndeks górny 22 LIndeks górny 55 | 5 | |
KIndeks górny 22 LIndeks górny 88 MIndeks górny 44 | 4 | |
KIndeks górny 22 LIndeks górny 88 MIndeks górny 88 | 8 |
Podsumowanie
Elektrony w atomie krążą w ściśle określonej przestrzeni wokół jądra (w obszarach zwanych powłokami elektronowymi).
Każda powłoka może pomieścić ograniczoną liczbę elektronów (2nIndeks górny 22, n – numer powłoki).
Rozmieszczenie elektronów w atomie nazywa się konfiguracją elektronową.
Ostatnia powłoka w atomie nosi nazwę powłoki walencyjnej, a elektrony poruszające się w jej przestrzeni to elektrony walencyjne.
Który z opisanych atomów ma największą liczbę elektronów walencyjnych? Podaj tę liczbę.
Numer atomu | 1 | 2 | 3 | 4 |
Opis atomu | atom sodu zawierający w jądrze atomowym 11 protonów | liczba masowa atomu = 19 |
Wśród atomów o liczbie atomowej od 1 do 18 znajdź grupy atomów, które mają jednakową liczbę elektronów walencyjnych. Policz, ile jest takich grup.
Słowniczek
elektrony poruszające się w zewnętrznej (często położonej najdalej od jądra atomowego; ostatniej) powłoce elektronowej w atomie
rozmieszczenie elektronów w atomie
powłoka, na której znajdują się elektrony walencyjne, często ostatnia (najbardziej zewnętrzna) powłoka elektronowa w atomie
Zadania
Wskaż nieprawidłowe zapisy konfiguracji elektronowej dla atomu pierwiastka o liczbie atomowej Z = 18.
- [1, 8, 2]
- [2, 2, 8]
- [8, 8, 2]
- [2, 8, 8]
Wskaż zapis, który przedstawia konfigurację elektronową atomu pierwiastka chemicznego o liczbie atomowej 17.
Określ prawdziwość zdań.
| Prawda | Fałsz | |
| Im bliżej jądra znajduje się dana powłoka elektronowa w atomie, tym więcej elektronów może ją tworzyć. | □ | □ |
| Zapis [2, 8, 2] przedstawia konfigurację elektronową atomu, który zawiera dwanaście elektronów. | □ | □ |
| Tylko w przypadku pierwszych dwóch powłok elektronowych obowiązuje reguła, według której elektrony mogą tworzyć kolejną powłokę dopiero po wypełnieniu powłoki niższej maksymalną liczbą elektronów. | □ | □ |
| Elektrony walencyjne znajdują się zawsze na pierwszej od jądra atomowego powłoce elektronowej. | □ | □ |
Uzupełnij luki w tekście. Wybierz właściwe określenie z listy.
osiemnaście elektronów, niższą, osiem elektronów, osiem elektronów, dwa elektrony, lokalizacją, całej, dwa elektrony, osiemnaście elektronów, wyższą, ściśle określonej, konfiguracją
Każdy elektron w atomie porusza się w ................................................ przestrzeni wokół jądra.
Im elektron znajduje się na powłoce bliżej jądra atomowego, tym ma ................................................ energię.
Umowny zapis przedstawiający rozmieszczenie elektronów w atomie nazywa się ................................................ elektronową.
Pierwsza powłoka może pomieścić maksymalnie ................................................,
trzecia zaś .................................................