Jądro atomowe i jego składniki
W 1911 r. Ernest Rutherford publikuje wyniki swoich badań, które dowodzą, że atom zbudowany jest z małego – w porównaniu z jego rozmiarami – jądra, w którym skupiona jest prawie cała masa atomu. Jądro atomu otacza powłoka elektronowa i atom jako całość pozostaje obojętny elektrycznie. Daje to początek nowej gałęzi fizyki – fizyce jądrowej, stawiającej sobie za cel poznanie tego nowo odkrytego elementu atomu.
stwierdzić, od czego zależą oddziaływania elektrostatyczne;
podać definicję kwantu energii promieniowania elektromagnetycznego;
obliczyć energię, którą przenosi kwant promieniowania elektromagnetycznego;
stwierdzić, że światło w określonych warunkach można traktować jako falę elektromagnetyczną, a w innych – jako strumień kwantów (fotonów, porcji energii);
wyjaśnić budowę atomu na podstawie modelu Bohra.
wymieniać cząstki, z jakich zbudowane jest jądro atomowe;
podawać definicję liczby masowej i atomowej;
podawać definicję izotopu pierwiastka;
podawać definicje kwarków i gluonów;
1. Jądro atomowe
W planetarnym modelu budowy atomu przedstawionym przez Rutherforda niemal cała masa atomu skupiona była w niewielkim jądrze () o ładunku dodatnim, a po zamkniętych orbitach krążyły elektrony, tworzące tzw. powłokę elektronową.
Odkrycie jądra atomowego sprawiło, że powstało wiele kolejnych wątpliwości. Uważano np., że jeśli jądro atomowe zbudowane byłoby z dodatnio naładowanych cząstek (protonów), musiałaby istnieć siła, która równoważyłaby ich wzajemne odpychanie wynikające z oddziaływań elektrycznych. Warto zdać sobie sprawę z faktu, że dwa protony znajdujące się w odległości rzędu odpychają się elektrostatycznie siłą o wartości . Ta wielkość nie wydaje się bardzo duża, ale trzeba pamiętać, że masa protonu wynosi ok. . Przez pewien czas uważano, że w jądrze znajdują się także elektrony. Dopiero odkrycie neutronu przez Jamesa ChadwickaJamesa Chadwicka w 1932 r. (istnienie neutronu zakładał dwanaście lat wcześniej Ernest Rutherford), pozwoliło wyjaśnić ten problem.
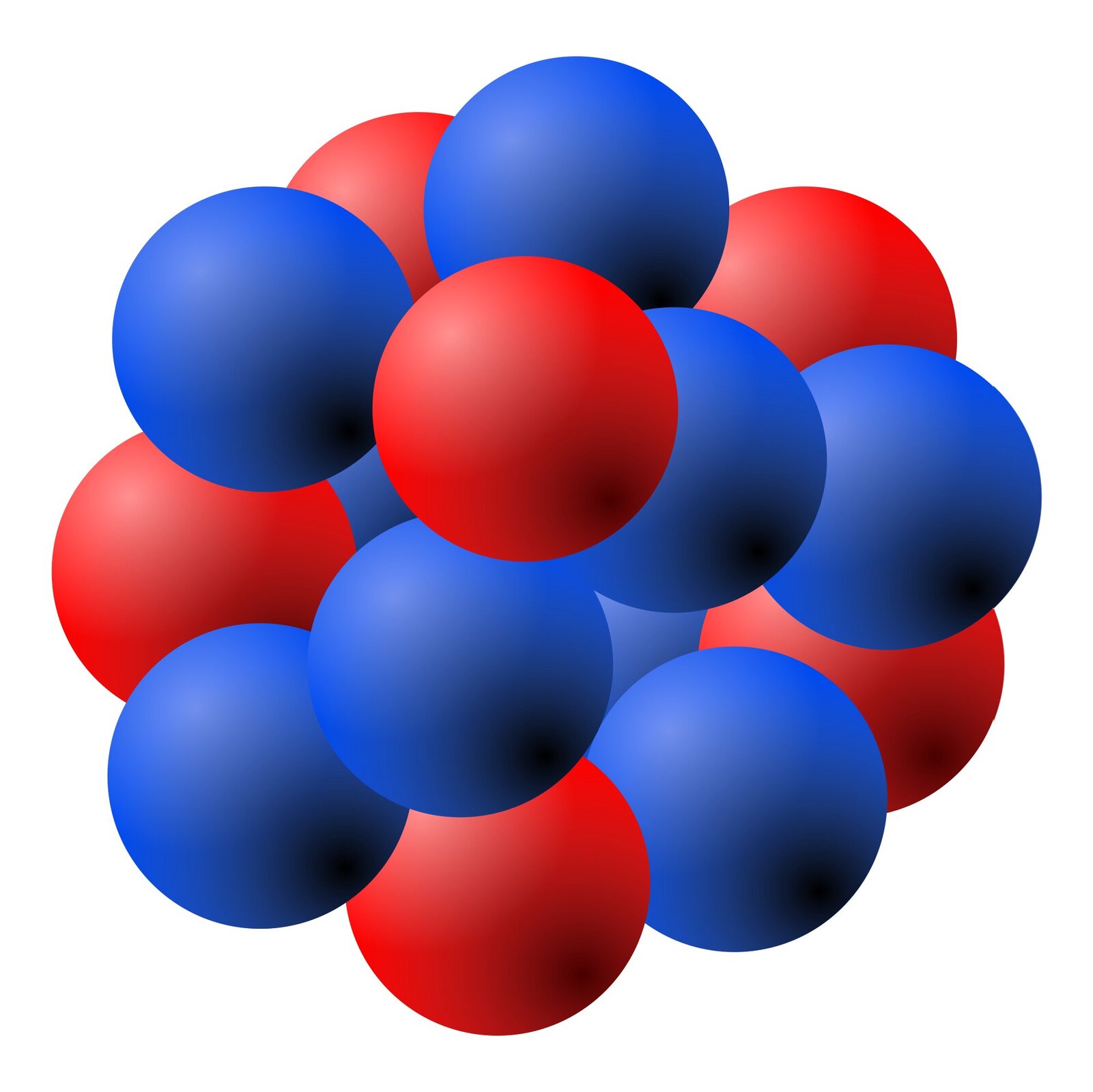
Obecnie wiemy, że jądro – centralna część atomu – zbudowane jest z nukleonównukleonów: protonów i neutronów.
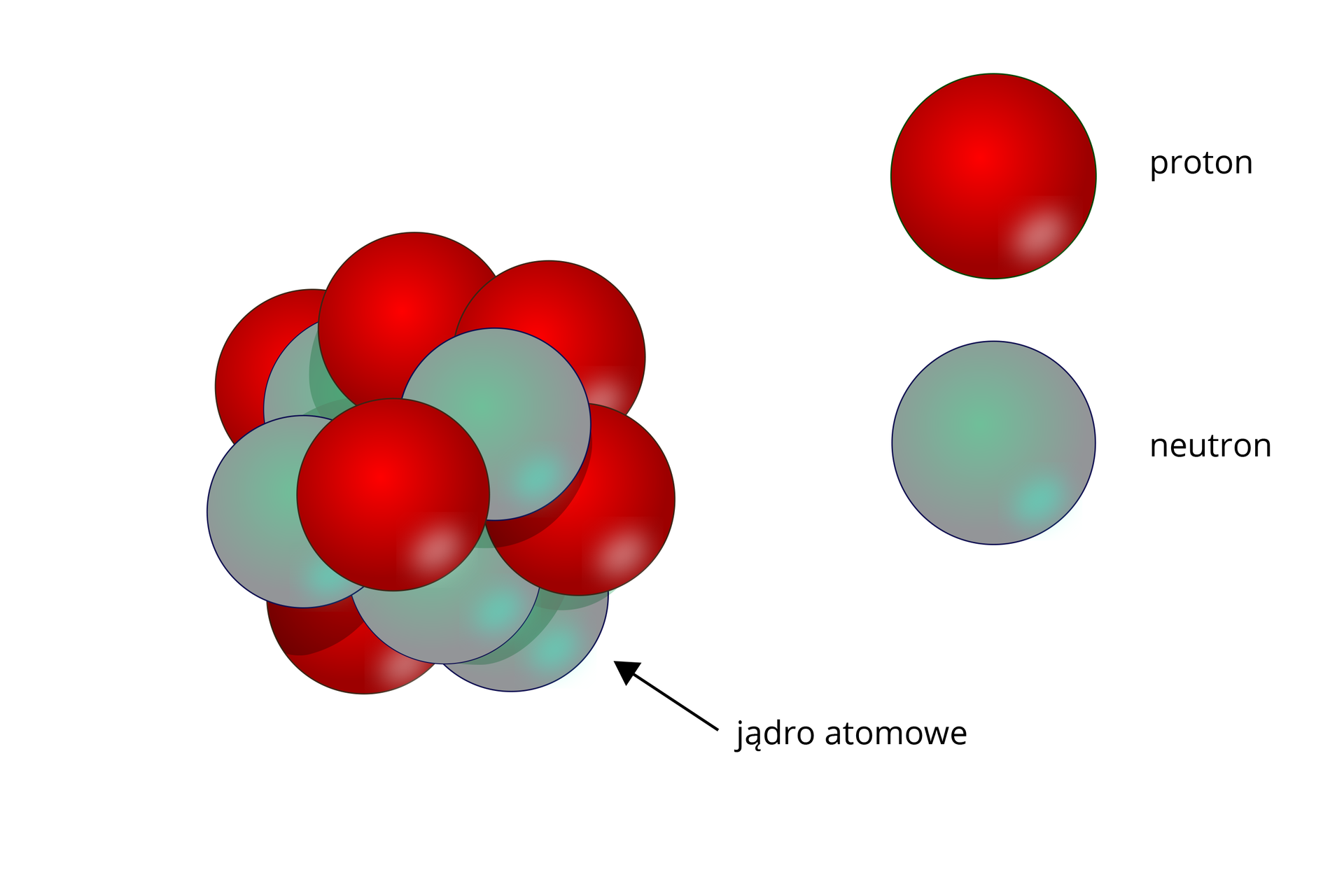
Nukleony wchodzące w skład jądra atomowego są podobnych rozmiarów oraz mają zbliżone masy. Proton ma ładunek , (), a neutron jest elektrycznie obojętny. Między składnikami jądra działają olbrzymie siły przyciągania o charakterze krótkozasięgowym, zdolne do pokonania elektrycznych sił odpychania między protonami. Są to siły jądrowesiły jądrowe.
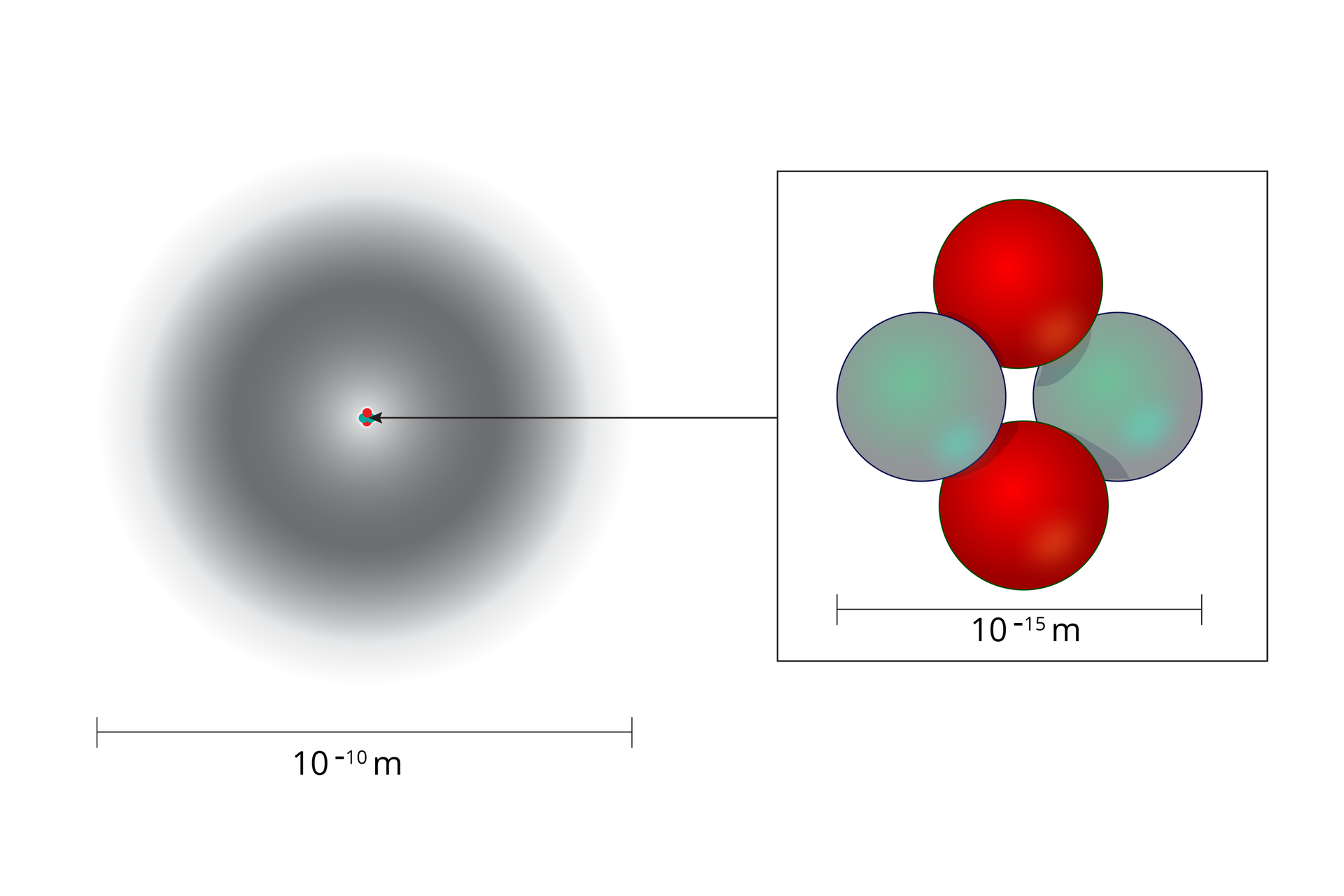
Jądro stanowi niewielką część całego atomu. Jeśli porównamy rozmiary atomu z rozmiarami jądra atomowego (dla atomu o średnicy rzędu ), okaże się, że jądro jest aż razy mniejsze od atomu, ale to właśnie w jądrze skupione jest masy całego atomu.

Film dostępny na portalu epodreczniki.pl
Animacja przedstawia porównanie atomu do boiska piłkarskiego. Na środku boiska pojawiają się przedmioty wskazywane przez lektora. Gdy lektor w dialogu odrzuca przedmiot jako nieodpowiedni, wędruje on w prawy, górny róg ekranu/kadru ciągnąc za sobą zanikającą smugę. Przedmiot ustawia się w górnej części ekranu i zostaje przekreślony na krzyż dwoma kreskami. Przekreślone przedmioty: piłka futbolowa, piłka tenisowa, piłeczka ping-pongowa, ziarnko grochu. Musi być zachowana skala wymiarów przedmiotów. Gdy lektor w monologu wymienia kolejny przedmiot pojawia się szpilka widoczna przez lupę (więc trochę powiększona – nie w skali) wyraźnie widoczny jest malutki łepek szpilki. Szpilka wędruje łukiem na środek boiska (w miarę oddalania się szpilki ta staje się coraz mniejsza) ciągnąc za sobą zanikającą smugę i tam „znika” bo jest zbyt mała by ją widzieć w skali rysunku. Pojawia się tylko strzałka wskazująca na środek boiska a nad nią napis szpilka.
Gdyby narysować model atomu z zachowaniem rzeczywistej skali jego elementów składowych, to dla jądra o rozmiarze kilku centymetrów średnica atomu przekroczyłaby . Wyobraźe sobie, że ponad objętości atomu stanowi pusta przestrzeń!
Odczytaj z tablic, ile nukleonów mają jądra: żelaza, niobu, wodoru i ołowiu.
2. Cząstki elementarne
W latach 30. XX wieku wprowadzono pojęciecząstek elementarnychcząstek elementarnych. Zaliczono do nich: elektrony, protony, neutrony i fotony. Jak widać, rodzajów tych cząstek nie było zbyt dużo. Badania promieniowania kosmicznego prowadzone w następnych latach oraz analiza produktów reakcji jądrowych (zderzanie dwóch jąder) doprowadziły do odkrycia ponad dwustu nowych rodzajów cząstek elementarnych o masach od kilkuset do kilku tysięcy razy większych niż masa elektronu. Większość cząstek o tak dużej masie (większej od masy protonu i neutronu) okazywała się zwykle nietrwała.
Eksperymentalnie udowodniono również eksperymentalnie istnienie tzw.antycząstekantycząstek. Należy do nich np. pozyton – cząstka o masie równej masie elektronu, ale o ładunku dodatnim. Pozyton został odkryty w produktach zderzeń cząstek atmosfery ziemskiej z cząstkami promieniowania kosmicznego – głównie protonami. W 1955 r. dokonano odkryciaantyprotonuantyprotonui wkrótce stało się jasne, że właściwie każda cząstka elementarna ma swoją antycząstkę. Model opisujący cechy cząstek elementarnych się skomplikował.
Warto wspomnieć także o polskim udziale w badaniach nad cząstkami elementarnymi. Dwaj polscy fizycy – Marian Danysz i Jerzy Pniewski – w 1952 r. odkryli tzw.hiperjądrohiperjądro. Hiperjądro zamiast jednego z neutronów zawierało cząstkę zwaną„hiperon lambda”„hiperon lambda”o ładunku zero i masie ok. 2200 razy większej niż masa elektronu. Obecnie (w myśl najnowszych teorii) większość tych cząstek nie jest jednak uważana za cząstki elementarne.
Fizycy dość szybko doszli do wniosku, że świat cząstek elementarnych jest jednak zbyt skomplikowany. W roku 1964 r.Murray Gell‑MannMurray Gell‑ManniGeorge ZweigGeorge Zweig wysunęli hipotezę, że dotychczasowy model cząstek elementarnych można uprościć, jeśli założy się istnieniekwarkówkwarków.
Jeśli nie lubicie fizyki, to powinniście wiedzieć, że Gell‑Mann również nie chciał jej studiować. A.K. Wróblewski w książce pt. „Historia fizyki” napisał, że interesował się on ornitologią, archeologią i lingwistyką, a do studiowania fizyki przekonał go ojciec. W 1969 r., w wieku czterdziestu lat, Gell‑Mann otrzymał Nagrodę Nobla za prace wcześniejsze niż hipoteza kwarków. Podobnie było z Jamesem Chadwickiem, który na fizykę w Manchesterze dostał się przez przypadek – na egzaminie usiadł w niewłaściwej ławce. Po egzaminie Chadwickowi oznajmiono mu, że został przyjęty na Wydział Fizyki. Ponieważ był nieśmiały, wstydził się przyznać do swojej pomyłki. W 1935 r. otrzymał Nagrodę Nobla za odkrycie neutronu.
3. Kwarki i gluony
Jak wspomnieliśmy, jeszcze w latach 60. XX wieku przyjmowano, że podstawowym budulcem atomów, a zarazem najmniejszymi, niepodzielnymi składnikami materii, są trzy rodzaje cząstek: neutrony, protony i elektrony. Okazało się jednak, że w skład protonu i neutronu wchodzą jeszcze mniejsze cząstki, tzw.kwarkikwarki.
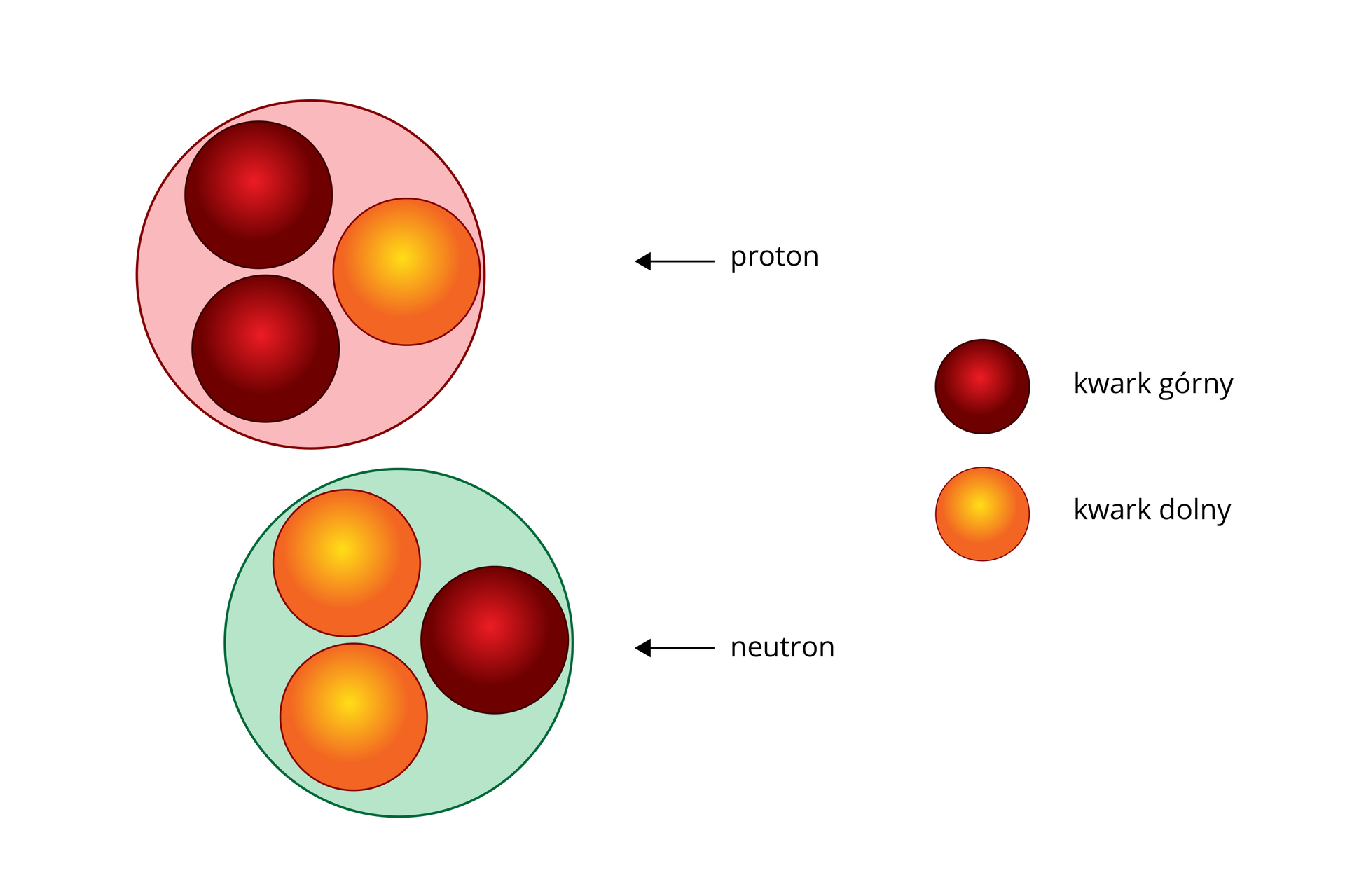
Hipoteza Gell‑Manna i Zweiga pozostawała przez pewien czas jedynie hipotezą. Kwarki nie występują jako cząstki swobodne. Skąd zatem wiadomo, że jednak istnieją?
Od 1968 r. zaczęto wykonywać cykl doświadczeń, w których badano zderzenia elektronów z protonami. Analiza wyników wykazała, że protony mają pewną wewnętrzną strukturę, a jej elementy są obdarzone ładunkiem elektrycznym. W 1990 r. Friedman, Kendall i Taylor otrzymali Nagrodę Nobla w dziedzinie fizyki „za ich pionierskie badania dotyczące głęboko nieelastycznego rozpraszania elektronów na protonach i wiązanych neutronach, co miało istotny wpływ na rozwój modelu kwarkowego w fizyce cząstek”.
Poniższa tabela przedstawia nazwy poszczególnych typów kwarków oraz wartości i znaki ich ładunków elektrycznych.
Nazwa | Symbol | Ładunek [e] |
górny | u | +⅔ |
dolny | d | −⅓ |
dziwny | s | −⅓ |
powabny | c | +⅔ |
niski, piękny | b | −⅓ |
wysoki, prawdziwy | t | +⅔ |
Kwarki utrzymują się razem dzięki cząstkom nazywanymgluonamigluonami, których nazwa pochodzi od angielskiego słowa „glue” – („klej”). Cząstki te powodują, że kwarki w protonie czy neutronie tworzą stabilny układ.
Czy proton i neutron są cząstkami elementarnymi? Uzasadnij swoją odpowiedź.
Składniki protonu to dwa kwarki u i jeden d. Składniki neutronu to dwa kwarki d i jeden u. Wykaż, że proton i neutron mają w związku z tym ładunki zgodne z obserwacjami.
4. Izotopy
Wiesz już, że jądro każdego atomu składa się z pewnej liczby dodatnio naładowanych protonów oraz elektrycznie obojętnych neutronów.
Liczbę protonów w jądrze oznaczamy literą „”. Jest to tak zwana liczba atomowaliczba atomowa lub porządkowa. Iloczyn jest ładunkiem jądra atomu. W atomie elektrycznie obojętnym liczba protonów w jądrze jest równa liczbie elektronów znajdujących się na powłokach wokół jądra. Z kolei liczba wszystkich nukleonów (protonów i neutronów) w jądrze jest oznaczana literą „”. To tzw.liczba masowaliczba masowa.
Będziemy używali pewnego symbolicznego, uproszczonego zapisu. Jeżeli dany pierwiastek będzie miał liczbę masową i liczbę atomową (porządkową) , zapis ten będzie wyglądał następująco:
Odmiany tego samego pierwiastka różniące się liczbą masową (liczbą neutronów) nazywamy izotopamiizotopami. Pierwiastki występujące w przyrodzie są mieszaninami swoich izotopów, w tym radioaktywnych (promieniotwórczych).
Jądra wszystkich izotopów danego pierwiastka mają tę samą liczbę atomową „”, ale różnią się wartościami liczby masowej „”.
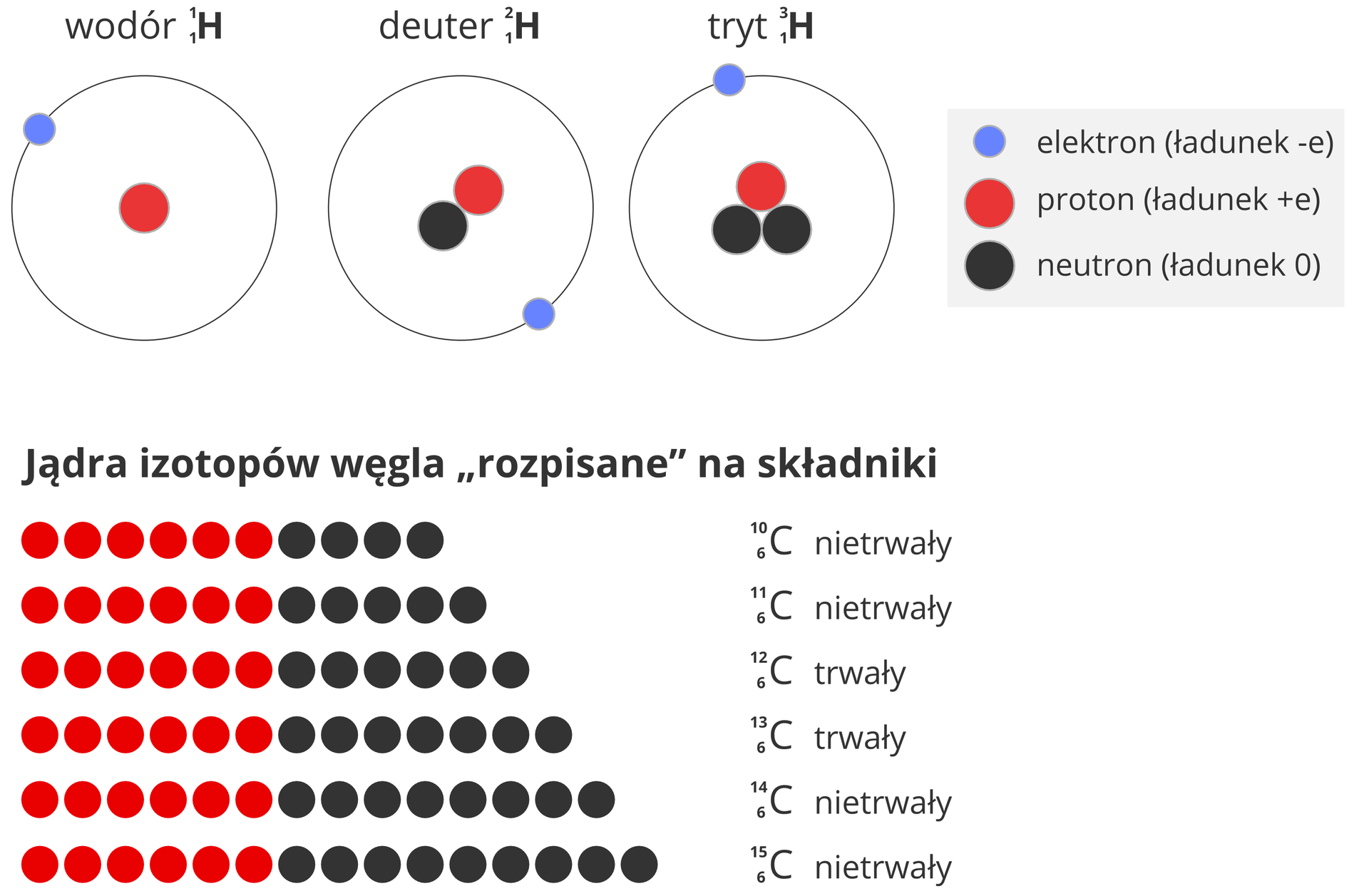
Przykładowo: wodór występuje w trzech odmianach. Oprócz zwykłej, dobrze znanej, gdzie w jądrze istnieje tylko jeden proton, jądro wodoru może mieć dodatkowo jeden lub dwa neutrony. Izotop wodoru z jednym neutronem i jednym protonem to tzw. deuter. Izotop wodoru z dwoma neutronami i jednym protonem to tryt.
Według przedstawionego wyżej zapisu symbolicznego zapisz liczby masowe i atomowe niobu, uranu, węgla i rtęci.
Podsumowanie
Atom zbudowany jest z ciężkiego jądra o niewielkich rozmiarach i powłoki elektronowej.
Elektrony krążą wokół jądra – poruszają się po zamkniętych orbitach; atom jest obojętny elektrycznie. W atomie obojętnym elektrycznie liczba protonów odpowiada liczbie elektronów.
Rozmiar jądra atomowego wynosi około , a atomu – .
Jądro – centralna część atomu – zbudowane jest z nukleonów: protonów i neutronów.
Masy protonu i neutronu są zbliżone (nieco większa jest masa neutronu). Ładunek protonu jest dodatni i równy wartości ładunku elementarnego ; neutron jest obojętny elektrycznie.
Przez wiele lat uważano, że proton i neutron to cząstki niepodzielne. Okazało się jednak, że zarówno proton, jak i neutron składają się jeszcze z tzw. kwarków. Kwarki oddziałują ze sobą za pomocą gluonów. Gluony „sklejają” ze sobą kwarki i w rezultacie powstają cząstki takie jak protony i neutrony. Panuje przekonanie, że kwarki są fundamentalnym budulcem materii i są niepodzielne.
Zwarta struktura jądra jest wynikiem równowagi między siłami odpychającymi, jakimi oddziałują na siebie protony (charakter elektryczny), a przyciągającymi siłami jądrowymi. Siły jądrowe są bardzo silne i działają na bardzo małych odległościach. Jądro atomu (z wyjątkiem atomu wodoru) nie mogłoby istnieć bez neutronów.
Liczbę protonów w jądrze (równą liczbie elektronów atomu) nazywamy liczbą atomową (porządkową) i oznaczamy literą „”. Ładunek jądra można obliczyć ze wzoru: .
Liczbę nukleonów (protonów i neutronów) nazywamy liczbą masową i oznaczamy literą „.
Symbolicznie budowę atomu opisujemy jako:
gdzie:
– symbol atomu pierwiastka;
– liczba masowa;
– liczba porządkowa (atomowa).Jądra atomowe większości pierwiastków mogą występować w odmianach różniących się liczbą neutronów. Pierwiastki posiadające w jądrze różną liczbę neutronów nazywamy izotopami danego pierwiastka.
Przykładami izotopów wodoru () mogą być deuter () i tryt (). Węgiel ma znane trzy izotopy: . Ten ostatni jest promieniotwórczy.
Wpisz odpowiednie symbole pierwiastków w miejsce czarnych kwadratów:
Zadania podsumowujące moduł
Które informacje są prawdziwe, a które fałszywe?
| Prawda | Fałsz | |
| Protony i neutrony to cząstki elementarne. | □ | □ |
| Protony i neutrony zbudowane są z innych cząstek nazywanych kwarkami. | □ | □ |
| W jądrze jest zawsze tyle samo protonów co neutronów. | □ | □ |
Uzupełnij tekst.
Pierwiastek, który zawiera w swoim jądrze 7 protonów i siedem neutronów to ............. Pierwiastek o liczbie atomowej wynoszącej 18 to ............. Jądro niobu ma 41 protonów i 52 neutronów, więc jego liczba masowa wynosi .............
Słowniczek
– cząstka będąca „lustrzanym odbiciem” cząstki elementarnejcząstki elementarnej; każdej cząstce elementarnej możemy przyporządkować antycząstkę o identycznej masie, czasie życia i innych cechach, ale o przeciwnym znaku ładunku (np. elektron – pozyton).
– antycząstkaantycząstka protonu.
– podstawowy i niepodzielny składniki materii Obecnie nie można sformułować ścisłej definicji tego pojęcia. Do cząstek elementarnych pierwotnie zaliczano proton, neutron i elektron; sytuację zmieniło odkrycie kwarków.
– bezmasowe niepodzielne cząstki, będące nośnikami silnych oddziaływań; spajają ze sobą kwarki w nukleonach.
– nietrwałe jądro atomowe, które dodatkowo (oprócz protonów i neutronów) ma co najmniej jeden hiperon.
– cząstka obojętna elektrycznie, która może stanowić składnik jądra atomowego.
– odmiana atomu tego samego pierwiastka, różniąca się liczbą neutronów.
– niepodzielne cząstki, z których zbudowane są protony i neutrony.
– liczba protonów w jądrze, oznaczana literą „Z”.
– liczba nukleonów w jądrze (suma protonów i neutronów tworzących jądro atomowe).
– składnik jądra atomowego; proton lub neutron.
– siły zdolne do pokonania elektrycznych sił odpychania między protonami; utrzymują jądro atomowe w całości. Charakteryzują się krótkim zasięgiem i olbrzymią wartością (stukrotnie większą niż siły oddziaływań elektrostatycznych).
Biogramy

James Chadwick
Brytyjski fizyk. W 1935 r. otrzymał Nagrodę Nobla za odkrycie neutronu – nowej cząstki w jądrze atomu. Współpracownik Ernesta Rutherforda, w czasie II wojny światowej uczestnik projektu „Manhattan”.

Murray Gell-Mann
Fizyk teoretyk. Prowadzi badania dotyczące fizyki cząstek elementarnych. Postulował istnienie hiperonu i kwarku. Wprowadził nową liczbę kwantową – dziwność.

George Zweig
George Zweig jeszcze jako student wysunął (niezależnie od Murraya Gell‑Manna) hipotezę, że cząstki takie jak neutron i proton mają określoną strukturę wewnętrzną i nie mogą być traktowane jako cząstki elementarne. Od lat 70. prowadzi badania w zakresie neurobiologii.