Alkohole wielowodorotlenowe
Niewielu z was, smarując ręce kremem glicerynowym, zdaje sobie sprawę z tego, że gliceryna to alkohol – tyle, że wielowodorotlenowy. Domyślamy się jednak, że jest nieszkodliwa dla zdrowia. Nie oznacza to wcale, że ta właściwość jest charakterystyczna dla wszystkich alkoholi z kilkoma grupami wodorotlenowymi. Popularny składnik płynu do chłodnic samochodowych, glikol etylenowy, jest silną trucizną. Co odróżnia te alkohole od etanolu czy metanolu?
jak są zbudowane cząsteczki alkoholi;
jak zapisuje się grupę funkcyjną alkoholi;
jaką wartościowość ma grupa funkcyjna alkoholi;
jaką wartościowość ma węgiel w związkach organicznych.
zapisywać wzory alkoholi wielowodorotlenowych na przykładzie gliceryny i glikolu etylenowego;
stosować nazwy zwyczajowe i systematyczne poznanych alkoholi wielowodorotlenowych;
wyjaśniać, dlaczego glicerol jest stosowany jako składnik kosmetyków;
badać właściwości glicerolu.
1. Budowa alkoholi wielowodorotlenowych
GlicerolGliceroljest pochodną propanu, w którym trzy atomy wodoru zostały zastąpione grupami wodorotlenowymi. Stąd pochodzi nazwa propanotriol. Glicerol w potocznym języku jest nazywany glicerynągliceryną. Pierwszy człon (propano-) pochodzi od węglowodoru, którego łańcuch wchodzi w skład alkoholu, tri- oznacza trzy grupy , a końcówka -ol jest charakterystyczna dla alkoholi.
Zaprojektuj model cząsteczki glicerolu.
Pamiętaj, że węgiel w związkach organicznych jest zawsze czterowartościowy, tlen – dwuwartościowy, a wodór – jednowartościowy. Grupa wodorotlenowa jest zawsze jednowartościowa. Użyj modeli zgodnie z proponowaną w tym podręczniku kolorystyką: atom wodoru symbolizuje kulka barwy białej, zaś atom tlenu – kulka barwy czerwonej.

Film dostępny na portalu epodreczniki.pl
Budowa modelu cząsteczki glicerolu
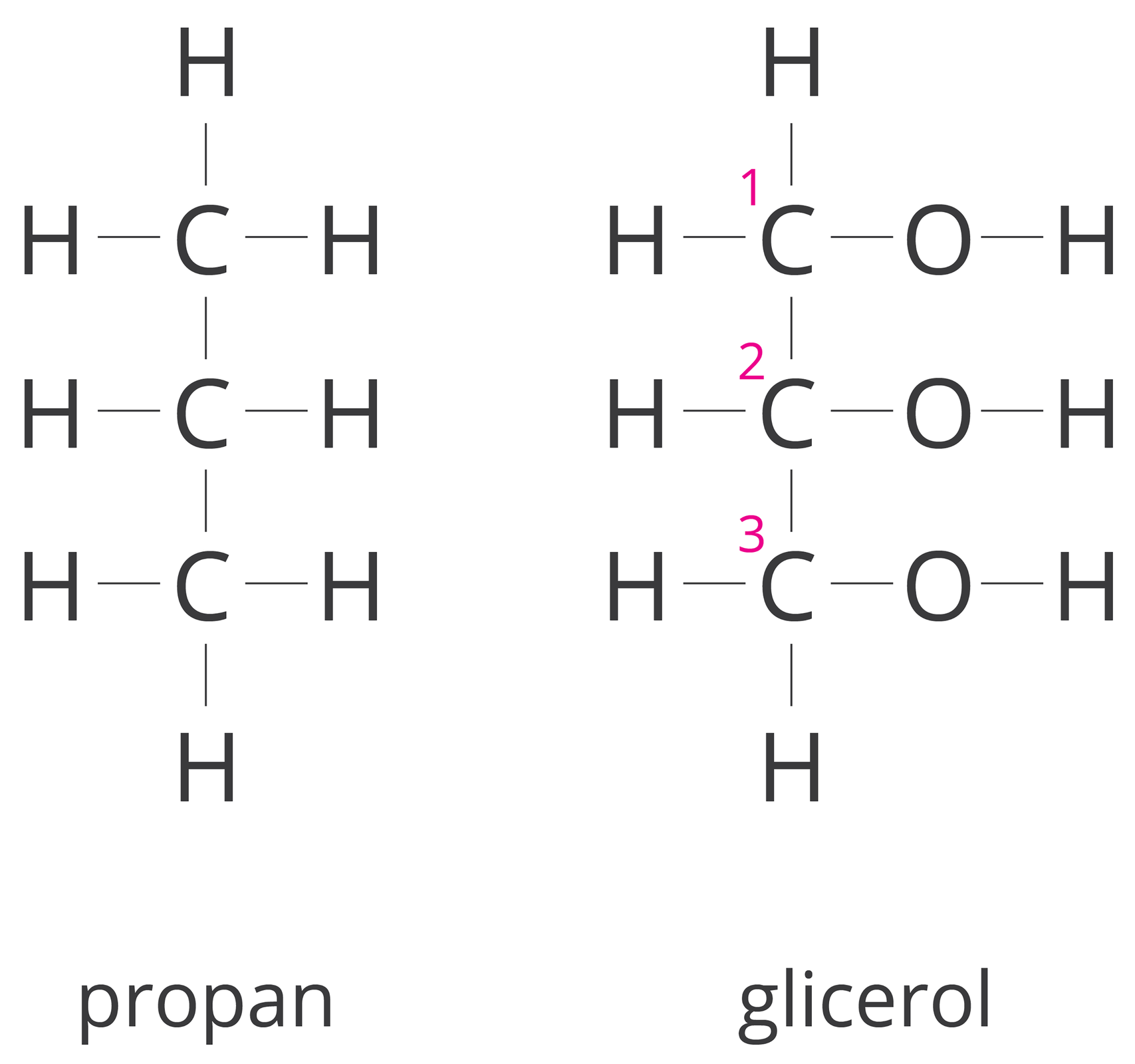
Propano‑1, 2, 3‑triol to nazwa systematyczna gliceryny. Jak wyjaśniono wyżej określenie propano- wskazuje, że związek ten jest pochodną propanu, numery: 1, 2, 3, tzw. lokantylokanty, informują, że każda grupa wodorotlenowa (grupa hydroksylowa)grupa hydroksylowa) jest połączona z innym atomem węgla, liczebnik tri- określa obecność trzech grup wodorotlenowych, a końcówka -ol potwierdza przynależność glicerolu do alkoholi.
Glikol etylenowy jest pochodną etanu, w którym dwa atomy wodoru zostały zastąpione grupami wodorotlenowymi. Nazwa systematyczna tego związku to etanodiol.


2. Właściwości fizyczne glicerolu

Właściwość fizyczna | Glicerol |
stan skupienia | ciecz |
barwa | bezbarwna |
rozpuszczalność w wodzie | bez ograniczeń |
temperatura wrzenia | 290°C |
gęstość | 1,26 g/cmIndeks górny 33 |
Glicerol (gliceryna) jest bezbarwną cieczą, dobrze rozpuszczalną w wodzie. Temperatura wrzenia i gęstość cieczy są wielkościami charakterystycznymi dla substancji i pozwalają na identyfikację danego alkoholu.
Jaką gęstość ma glicerol względem gęstości wody?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Glicerol unosi się na powierzchni wody.
Woda o mniejszej gęstości unosi się na powierzchni glicerolu.
Glicerol nie rozpuszcza się w wodzie.
glicerol,
probówka,
woda zabarwiona niebieskim atramentem.
Do probówki z wodą zabarwioną atramentem powoli wlej glicerol po ściankach probówki, tak aby ciecze się nie mieszały.
Zaobserwuj, która ciecz znajduje się w dolnej warstwie mieszaniny.
Energicznie wstrząśnij probówką.
Zaobserwuj, czy glicerol rozpuścił się w wodzie.
Zauważamy wyraźne dwie warstwy cieczy. W górnej warstwie znajduje się woda z atramentem, a w dolnej – bezbarwny glicerol. Po wymieszaniu obu cieczy granica między warstwami zanika.

3. Właściwości chemiczne glicerolu
Wykonując kolejne doświadczenia, przekonamy się, jakie właściwości chemiczne ma glicerol. Czy reaguje podobnie jak etanol? Czy obecność trzech grup wodorotlenowych wpływa na odczyn wodnych roztworów glicerolu? Czy na etykietach glicerolu umieszcza się znaki ostrzegawcze?

Zapach i smak glicerolu
Glicerol nie ma zapachu. Ma słodki smak i cecha ta ma duże znaczenie dla jego różnorodnych zastosowań.
Spalanie glicerolu
Glicerol, podobnie jak inne alkohole, ulega spalaniu. Do zapoczątkowania reakcji konieczne jest jego wstępne ogrzanie. W zależności od ilości dostępnego tlenu spalanie glicerolu może zachodzić w sposób całkowity lub niecałkowity.
Jak rozpoznać niecałkowite spalanie glicerolu?
Wydzielanie się sadzy podczas spalania glicerolu potwierdzi,że zachodzi reakcja spalania niecałkowitego.
glicerol,
parownica,
trójnóg z siatką ceramiczną,
palnik.
Do parownicy porcelanowej wlej ok. 2 cmIndeks górny 33 glicerolu.
Zbadaj jego palność.
Delikatnie ogrzej parownicę z glicerolem.
Ponownie zbadaj palność.
R1NNrLaF1VDFq1  Źródło: Dariusz Adryan, licencja: CC BY 3.0.
Źródło: Dariusz Adryan, licencja: CC BY 3.0.
Spalaniu glicerolu towarzyszy kopcący płomień, który świadczy o wydzielającej się sadzy.
Produktem niecałkowitego spalania glicerolu są węgiel i woda.
Produktami całkowitego spalania glicerolu są tlenek węgla(IV) i woda.

Film dostępny na portalu epodreczniki.pl
Na ekranie dwie cząsteczki glicerolu reagują z siedmioma cząsteczkami tlenu. W wyniku reakcji powstaje sześć cząsteczek dwutlenku węgla i osiem cząsteczek wody.
Odczyn glicerolu
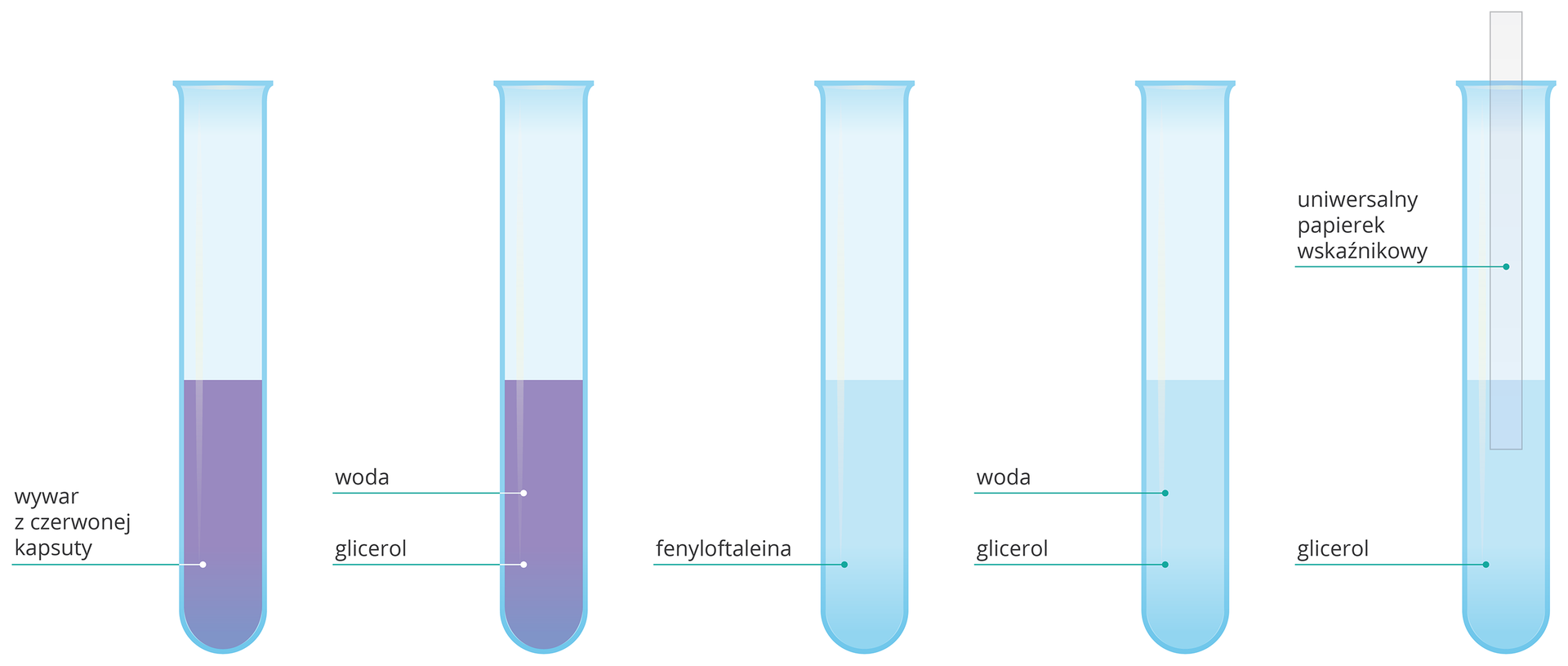
Czy odczyn glicerolu jest taki sam jak odczyn metanolu i etanolu?
Alkohole wielowodorotlenowe mają identyczny odczyn jak alkohole jednowodorotlenowe.
Wskaźniki nie zmienią swojego zabarwienia. W roztworze glicerolu nie ma jonów.
trzy probówki,
wodny roztwór glicerolu,
wywar z czerwonej kapusty,
fenoloftaleina,
uniwersalny papierek wskaźnikowy.
Do trzech probówek wlej po ok. 3 cmIndeks górny 33 glicerolu.
Do jednej probówki dodaj kilka kropli wywaru z czerwonej kapusty, do drugiej – kroplę fenoloftaleiny, a w kolejnej zanurz uniewersalny papierek wskaźnikowy papierek.
Obserwuj próbki.
R1Z5tpMMULbns1  Źródło: Dariusz Adryan, Aleksandra Ryczkowska, licencja: CC BY 3.0.
Źródło: Dariusz Adryan, Aleksandra Ryczkowska, licencja: CC BY 3.0.
Wskaźniki dodane do roztworów glicerolu nie zmieniły swojego zabarwienia. Odczyn wodnego roztworu glicerolu jest obojętny.
Czy wodny roztwór glicerolu przewodzi prąd elektryczny?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Wodny roztwór glicerolu dobrze przewodzi prąd elektryczny.
Roztwór glicerolu nie przewodzi prądu elektrycznego.
glicerol,
woda,
zlewka, urządzenie – wskaźnik przewodnictwa prądu elektrycznego.
Zlewkę napełnij glicerolem zmieszanym z wodą.
Zanurz w cieczy elektrody aparatu do pomiaru przewodnictwa elektrycznego.
Zwróć uwagę na to, czy zaświeciła się żarówka.
Żarówka aparatu do pomiaru przewodnictwa elektrycznego nie zaświeciła się. Świadczy to o braku przewodnictwa prądu elektrycznego, a tym samym – o braku jonów w roztworze.
W roztworze wodnym glicerolu nie ma jonów ani jonów . Glicerol nie ulega procesowi dysocjacji elektrolitycznej, nie jest więc elektrolitem.
4. Zastosowanie glicerolu
W kosmetyce stosuje się dwa rodzaje glicerolu – naturalną i pochodzenia petrochemicznego.
Glicerol pozyskuje się m.in. z tłuszczu kokosowego.
Glicerol ma właściwości higroskopijnehigroskopijne i w naturalny sposób osłania skórę, wiążąc wodę niezbędną do zachowania prawidłowego nawilżenia skóry. Skutecznie nawilża przesuszoną skórę. Wygładza, poprawia elastyczność, reguluje procesy odnowy naskórka. Jest dodawany do niemal wszystkich kremów do rąk, kremów do twarzy i balsamów.

Glicerol jest stosowany jako substancja słodząca w syropach przeciwkaszlowych. Służy również do produkcji materiałów wybuchowych (nitrogliceryna). Ma wiele zastosowań w medycynie, gdyż łatwo wchłania się do przewodu pokarmowego. Doustne preparaty glicerolu mają łagodne działanie przeczyszczające.
Gliceryna paszowa, pozyskiwana z tłuszczów roślinnych, jest stosowana jako dodatek do pasz dla krów i trzody chlewnej. Jest smaczna, utrzymuje wilgotność paszy, dostarcza energii oraz wpływa np. na mleczność krów i przyrost masy trzody.
W reakcji glicerolu z kwasem azotowym(V) powstaje nitrogliceryna, czyli ester glicerolu i kwasu azotowego(V). Jest to środek bardzo wrażliwy na wstrząsy. Wystarczy minimalna ilość energii, np. podczas uderzenia, aby doprowadzić do wybuchowego rozkładu nitrogliceryny. Nitrogliceryny używa się do produkcji dynamitu. Stosuje się ją również w medycynie jako środek rozszerzający naczynia krwionośne.
Zastanów się, dlaczego kremy kosmetyczne i pasty do zębów nie wysychają, mimo że często są przechowywane w otwieranych opakowaniach. Jaki składnik decyduje o utrzymaniu konsystencji kremu? Zapoznaj się z treścią etykiet różnych kosmetyków. Wskaż kremy, które zawierają glicerol.


5. Właściwości i zastosowanie glikolu etylenowego
Glikol etylenowy jest bezbarwną cieczą o dużej lepkości. Dobrze rozpuszcza się w wodzie. Jest substancją trującą. Stosuje się go do wyrobu włókien sztucznych, farb i niezamarzających płynów do chłodnic samochodowych.

Podsumowanie
Glicerol i gliceryna to nazwy zwyczajowe tego samego związku chemicznego – propanotriolu.
Cząsteczka glicerolu ma w swym składzie trzy grupy wodorotlenowe.
Glicerol to gęsta oleista, bezbarwna i bezwonna ciecz o słodkim smaku. Nie jest substancją trującą.
Glicerol ma wiele zastosowań w przemyśle kosmetycznym, spożywczym, włókienniczym.
Napisz równanie reakcji spalania glicerolu, jeżeli jednym z produktów będzie gaz powodujący mętnienie wody wapiennej.
Podaj wartość pH wodnego roztworu glicerolu i wyjaśnij, w jaki sposób można się o tym przekonać doświadczalnie.
Wyjaśnij, jakie właściwości glicerolu decydują o jego zastosowaniu w kosmetyce.
Słowniczek
nazwa zwyczajowa alkoholu o nazwie systematycznej propano‑1,2,3‑triol
nazwa zwyczajowa alkoholu o nazwie systematycznej propano‑1,2,3‑triol
inaczej grupa wodorotlenowa
liczba przypisana atomom węgla w łańcuchu węglowym
substancja pochłaniająca wodę lub parę wodną z otoczenia
Zadania
Ile wiążących par elektronowych znajduje się w jednej cząsteczce glicerolu?
- 13
- 6
- 7
- 8
- 9
- 10
- 11
- 12
Oceń, czy podane informacje są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Jednym z produktów niecałkowitego spalania glicerolu jest woda. | □ | □ |
| Jednym z produktów niecałkowitego spalania glicerolu jest węgiel. | □ | □ |
| Jednym z produktów niecałkowitego spalania glicerolu jest tlenek węgla(IV). | □ | □ |
| Jednym z produktów całkowitego spalania glicerolu jest woda. | □ | □ |
| Jednym z produktów niecałkowitego spalania glicerolu jest tlen. | □ | □ |
Połącz wzory sumaryczne podanych alkoholi z ich nazwami.
glicerol, etanol, metanol, glikol etylenowy
Uzupełnij luki w tekście. Wybierz właściwe określenia spośród podanych.
cztery, jeden, trzy, zasadowy, kwasowy, jednowodorotlenowych, wielowodorotlenowych, trzy, dwie, dwa, obojętny
Glicerol jest pochodną węglowodoru nasyconego zawierającego ........................................ atomy węgla w cząsteczce. W cząsteczce glicerolu występują ........................................ grupy wodorotlenowe. Glicerol należy do alkoholi ......................................... Odczyn wodnego roztworu glicerolu jest ........................................ i dlatego dodatek soku z czerwonej kapusty nie powoduje zmiany jej zabarwienia.