Przeczytaj
Kinetyka chemiczna to dział chemii fizycznej, analizujący szybkość reakcji chemicznych w różnych warunkach ciśnienia, temperatury oraz stężenia i natury reagentów. Dziedzina ta pozwala na poznanie mechanizmu reakcjimechanizmu reakcji, szybkości poszczególnych etapów oraz produktów pośrednichproduktów pośrednich, które mogą pojawiać się na drodze od substratu do produktu. Do opisu procesów zachodzących w mieszaninie reakcyjnej służą równania matematyczne.
Do najważniejszych pojęć związanych z tą nauką należą:
szybkość;
częsteczkowość;
rząd;
stała szybkościstała szybkości;
rozdrobnienie.
Reakcja chemiczna to przemiana jednego lub większej ilości substratów w jeden lub kilka różnych produktów. Niektóre reakcje przebiegają nieodwracalnienieodwracalnie, tzn. do wyczerpania substratu. Wówczas w równaniu stechiometrycznym reakcji stawia się strzałkę w jednym kierunku.
Natomiast w przypadku reakcji odwracalnychodwracalnych stosuje się dwie przeciwnie skierowane strzałki, podkreślając tym samym, że reakcja biegnie w dwóch kierunkach do momentu uzyskania stanu równowagi.
Szybkość reakcji
Każda reakcja chemiczna charakteryzuje się różną szybkością. O szybkości reakcji można wnioskować po ubytku ilości substratu bądź po przyroście ilości produktu. Dlatego też szybkość reakcji chemicznej wyraża się jako zmianę stężenia molowego substratów lub produktów w jednostce czasu. Co więcej, nie jest to wielkość stała, ponieważ zmienia się w czasie przebiegu reakcji. Największa jest na początku reakcji, a najmniejsza pod koniec.
Zmiany te wizualnie można zaobserwować za pomocą krzywych kinetycznych, opisujących zmiany stężenia substratu i produktu w czasie.

Szybkość reakcji chemicznej uzależniona jest od rodzaju reakcji, jednak mogą na nią wpływać czynniki, takie jak:
temperatura;
stężenie reagentów;
stosowane rozpuszczalniki;
zastosowanie katalizatorówkatalizatorów bądź inhibitorówinhibitorów.
Zwiększenie szybkości reakcji jest możliwe poprzez zastosowanie większej temperatury. Z własnego doświadczenia wiesz, jak sól rozpuszcza się w zimnej lub gorącej wodzie i jak jej rozdrobnienie zwiększa szybkość rozpuszczania. Innym przykładem obrazującym tę zależność jest reakcja zachodząca między magnezem a kwasem solnym. W jej trakcie obserwuje się wydzielanie pęcherzyków wodoru. Szybkość tej reakcji rośnie po podgrzaniu i/lub przy zastosowaniu rozdrobnionego magnezu.
Ponadto na szybkość reakcji wypływa zastosowanie katalizatorów lub inhibitorów, które nie ulegają zużyciu w czasie jej przebiegu. Wyróżniamy katalizatory/inhibitory homogeniczne, czyli będące w takiej samej fazie, co substraty, oraz heterogeniczne, będące w innej fazie niż substraty.
Jeżeli mamy do czynienia z reakcją przebiegającą w jednym etapie od substratów do produktów, to jest to reakcja elementarna. Aby określić cząsteczkowość reakcji, należy zastanowić się, ile cząsteczek substratu (atomów, cząsteczek, jonów lub rodników) bierze udział w danej reakcji elementarnej. Reakcja, w której zaangażowany jest jeden substrat, nazywana jest jednocząsteczkową i podobnie – reakcje z dwoma substratami, to reakcje dwucząsteczkowe, z trzema, to trójcząsteczkowe. Przykładem dwucząsteczkowej reakcji elementarnej jednoetapowej jest synteza jodowodoru.
Należy jednak pamiętać, że większość reakcji ma skomplikowane mechanizmy i zachodzi na drodze kilku etapów. Są to m.in. reakcje katalityczne, enzymatyczne oraz łańcuchowe.
Rzędowość reakcji chemicznej
Badania reakcji chemicznych wykazały, że ich szybkość jest wprost proporcjonalna do iloczynu stężeń molowych substratów, ponieważ od ilości substratów zależy prawdopodobieństwo zderzeń poszczególnych cząsteczek, w celu utworzenia oczekiwanego produktu. Wykładniki potęg poszczególnych stężeń molowych substratów określają cząstkowy rząd reakcji chemicznej (względem danego substratu), a ich suma całkowity rząd reakcji chemicznej.
Dla powyższej reakcji chemicznej równanie kinetycznerównanie kinetyczne na szybkość reakcji chemicznej to:
gdzie – stała szybkości reakcji.
Wartość k wyznacza się doświadczalnie – stała szybkości reakcji zależy od rodzaju reakcji i temperatury, a nie zależy od stężenia reagentów.
Z równania tego wynika, że rząd reakcji wynosi (, suma wykładników potęg poszczególnych substratów, ponieważ współczynniki stechiometryczne wynoszą dla oraz dla ). Równania kinetyczne dla reakcji złożonych, składających się z kilku etapów, ustala się doświadczalnie i często nie odzwierciedlają one równania stechiometrycznego reakcji. Wówczas rzędowość reakcji nie musi być wartością całkowitą, jak w przypadku prostych reakcji.
Do przeanalizowania kinetyki reakcji chemicznej na wykresie konieczne jest poznanie zależności dla: reakcji zerowego rzędu, reakcji rzędu oraz reakcji rzędu.
Reakcje zerowego rzędu
Reakcjami zerowego rzędu są te, których szybkość nie jest uzależniona od stężenia substratów. Są to, np. reakcje fotochemiczne, ich szybkość zależy od natężenia padającego promieniowania. Dla takich reakcji równanie kinetyczne wygląda następująco:
gdzie:
– stężenie molowe substratu pozostałe po ;
– początkowe stężenie molowe substratu;
– stała szybkości reakcji;
– czas przebiegu reakcji.
Z powyższego równania reakcji wynika, że reakcja zerowego rzędu ma liniowy ubytek stężenia substratu (lub liniowy przyrost stężenia produktu) w czasie reakcji. Wykres tej zależności wygląda tak, jak poniżej.
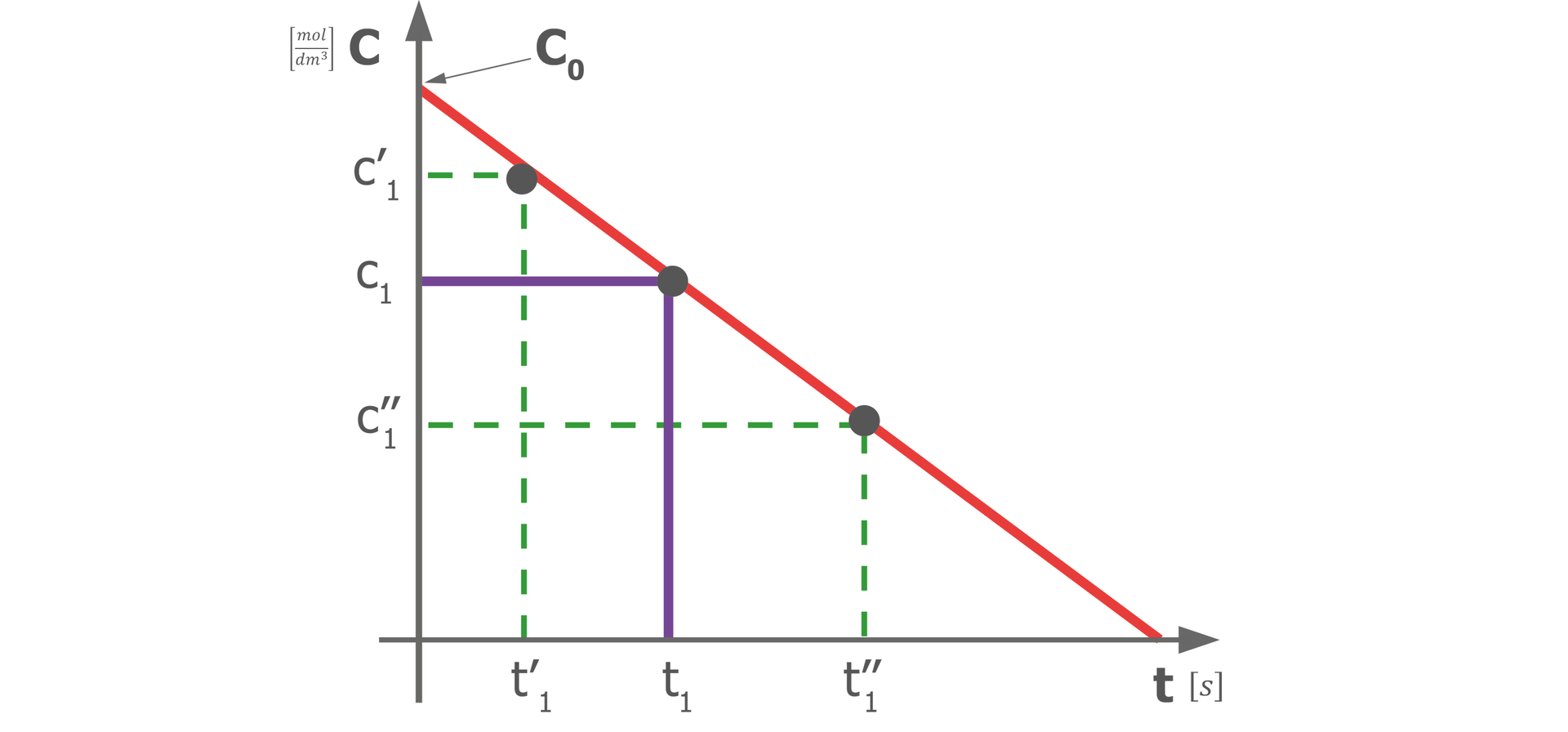
Reakcje rzędu
Reakcjami rzędu są reakcje, dla których rząd reakcji wynosi . Dla takich reakcji równanie kinetyczne ma postać:
gdzie:
– stężenie molowe substratu pozostałe po czasie ;
– początkowe stężenie molowe substratu ;
– stała szybkości ;
– czas przebiegu reakcji ;
– logarytm naturalny o podstawie (liczba Eulera), gdzie
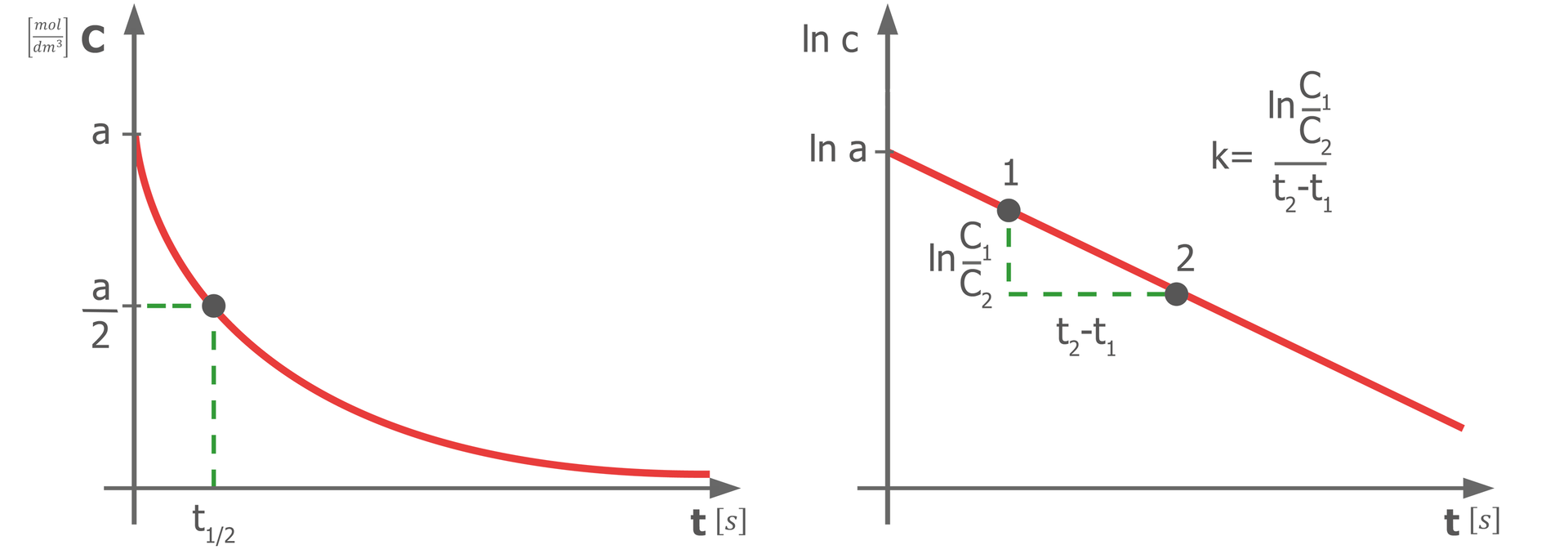
Powyższe wyrażenie można również zapisać jako zależność masy ( i ), liczby moli ( i ) lub liczby cząsteczek ( i ). Wówczas:
Dla poniższej reakcji stała szybkości wynosi .
Uzupełnij tabelę i stwórz wykres zależności stężenia molowego substratu w czasie oraz wykres zależności chwilowych szybkości reakcji w czasie. Stężenie początkowe substratu wynosiło .
Uzupełnij tabelę. Oblicz zależność stężenia molowego substratu w czasie oraz zależność chwilowych szybkości reakcji w czasie. Stężenie początkowe substratu wynosiło .
Reakcje rzędu
Reakcjami rzędu są reakcje, dla których rząd reakcji wynosi . Dla takich reakcji równanie kinetyczne ma postać:
gdzie:
– stężenie molowe substratu pozostałe po czasie ;
– początkowe stężenie molowe substratu ;
– stała szybkości ;
– czas przebiegu reakcji .

Słownik
jest współczynnikiem proporcjonalności w równaniu kinetycznym, wyznaczonym doświadczalnie, charakterystycznym dla danej reakcji chemicznej, który zależy od temperatury i katalizatora, ale nie zależy od stężenia reagentów
opis dokładnego przebiegu reakcji chemicznej, wskazujący na produkty pośrednie powstające w trakcie reakcji
każde indywiduum chemiczne występujące w złożonych reakcjach chemicznych, powstałe z substratów lub innych produktów pośrednich
reakcja przebiegająca tylko w jednym kierunku
reakcja, która przebiega w obu kierunkach w celu osiągnięcia stanu równowagi
(gr. katalysis „rozkład”) substancja chemiczna, której dodatek do reakcji powoduje przyspieszenie reakcji chemicznej; po zakończeniu reakcji jest w całości odzyskiwana
(łac. inhibitio „powstrzymanie”) substancja chemiczna, której dodatek do reakcji powoduje spowolnienie lub zatrzymanie reakcji chemicznej; po zakończeniu reakcji jest w całości odzyskiwana
zależność szybkości reakcji chemicznej od stężenia reagentów i temperatury
Bibliografia
Bełtowska‑Brzezinska M., Podstawy kinetyki chemicznej. Skrypt do wykładów, Poznań 2009.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Chemia ogólna i nieorganiczna, Gdynia 2005.


