Przeczytaj
Badanie odczynu pH fenolu
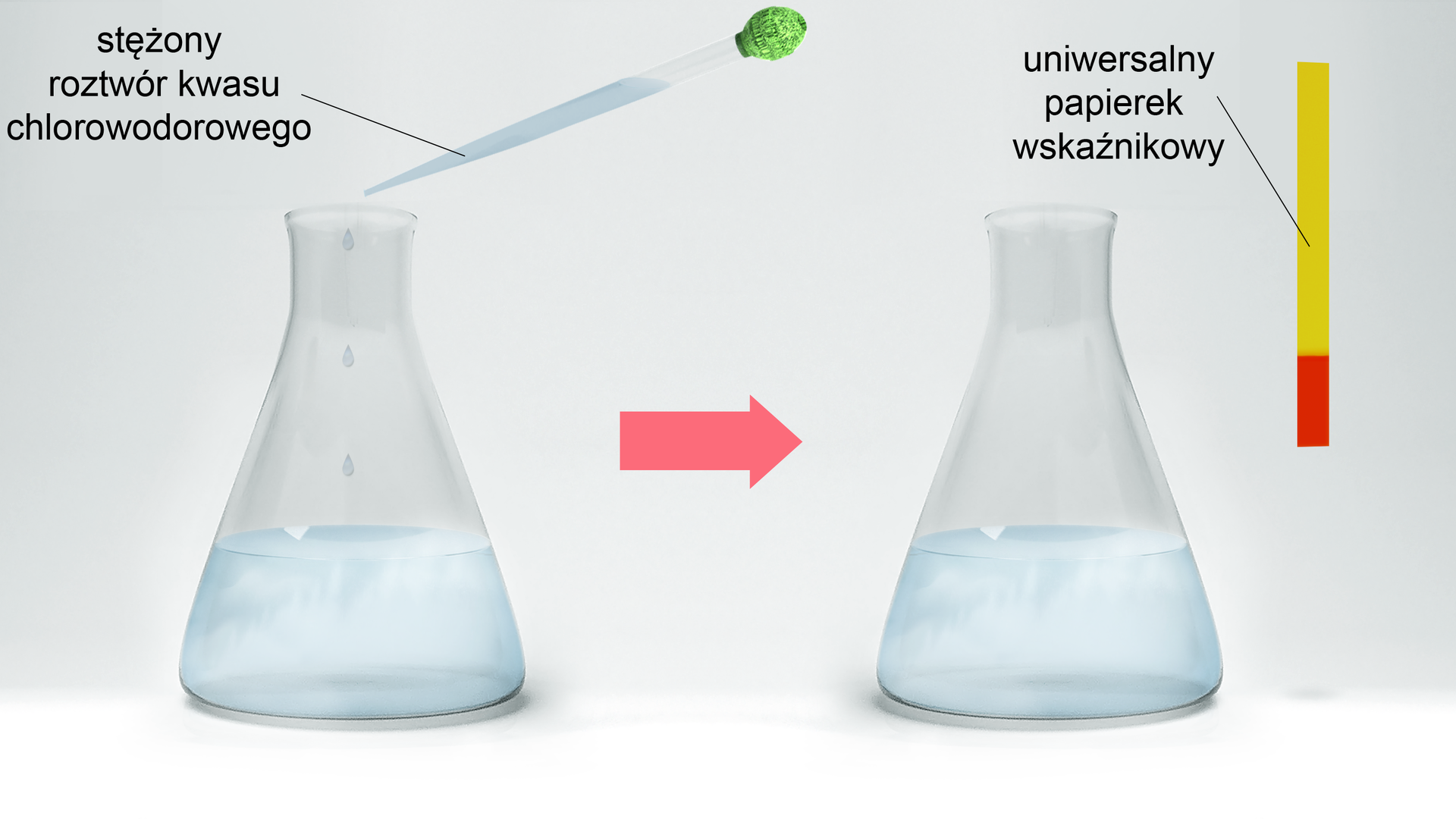
W oparciu o poniższy schemat doświadczenia zapisz problem badawczy i wywnioskuj, jaki odczyn pH wykazuje fenol.
W oparciu o opis schematu doświadczenia zapisz problem badawczy i wywnioskuj, jaki odczyn pH wykazuje fenol.
Doświadczenie
Schemat doświadczenia:
Reakcja chemiczna:

Kwasowość fenolu
Fenol wykazuje właściwości kwasowe, ponieważ w wyniku procesu dysocjacji elektrolitycznejdysocjacji elektrolitycznej powstaje anion fenolanowy i kation hydroniowy.

Zapoznaj się z poniższym doświadczeniem, a następnie podaj hipotezę oraz wnioski.
Zapoznaj się z opisem doświadczeniem, a następnie podaj hipotezę oraz wnioski.
Doświadczenie
Schemat doświadczenia:
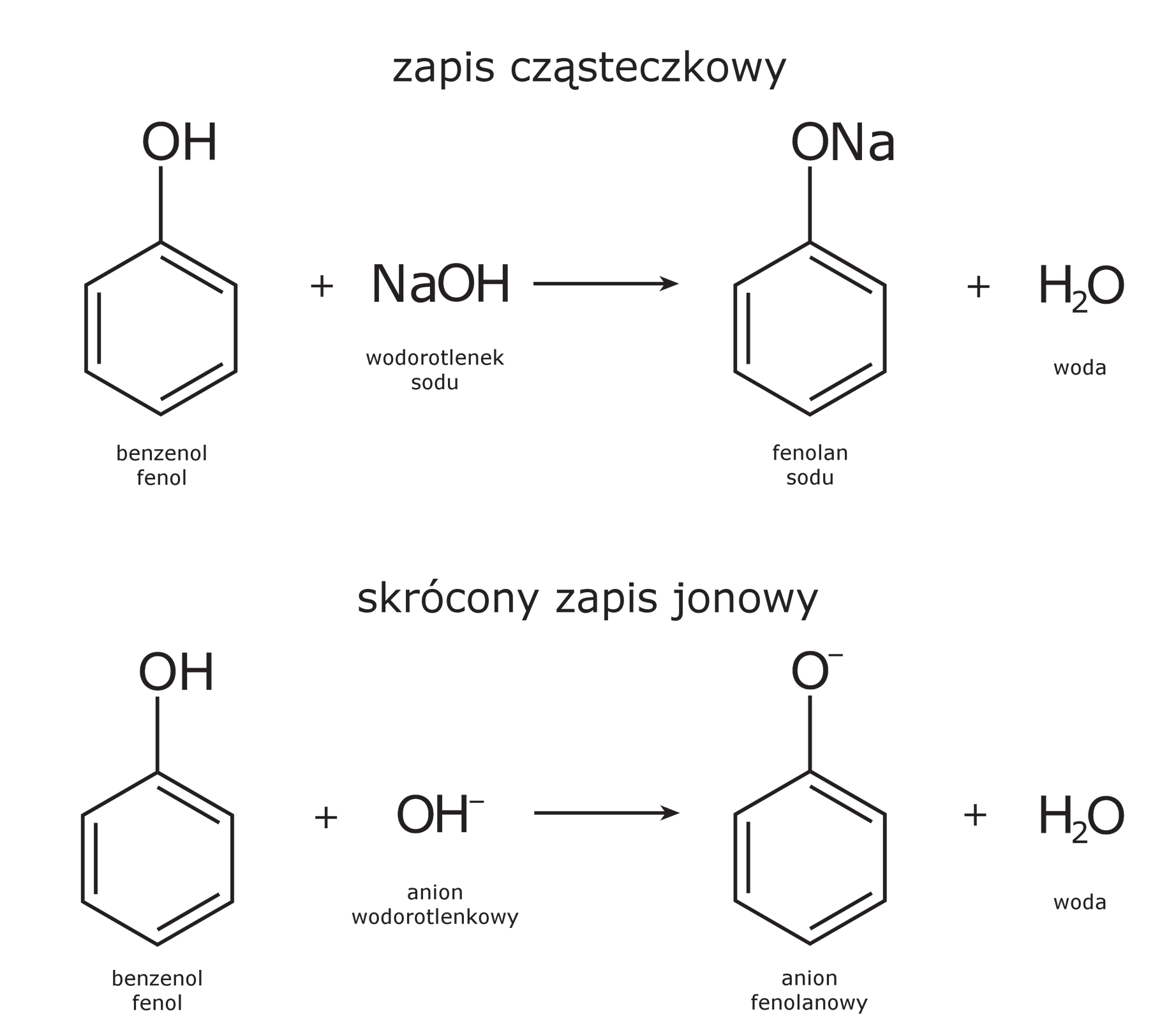
Fenol jest słabszym kwasem niż kwas chlorowodorowy, ponieważ zostaje wyparty z jego roztworu soli.

Porównanie kwasowości fenolu na tle innych substancji
Wielkości, które pozwalają porównać kwasowość substancji, to:
stała dysocjacjistała dysocjacji – , która jest wielkością charakterystyczną dla danego elektrolitu. Na przykład stałą dysocjacji fenolu można przedstawić następująco:
:
Im większa wartość stałej dysocjacji (), tym silniejsza kwasowość substancji. Im mniejsza wartość , tym silniejsza kwasowość substancji.
Wzór substancji | Nazwa systematyczna substancji | Nazwa zwyczajowa substancji | Stała dysocjacji lub i | |
|---|---|---|---|---|
 Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | Benzenol | Fenol | ||
Kwas chlorowodorowy | Kwas solny | |||
Kwas | - | |||
Należy pamiętać, że wzór nie jest wzorem hydratu, ale kwasu węglowego, który jest bardzo nietrwałym kwasem; dlatego przedstawiony został w taki sposób. | Kwas węglowy | - | ||
Kwas metanowy | Kwas mrówkowy | |||
Kwas etanowy | Kwas octowy |
Porównując wartości stałej dysocjacji powyższych substancji, możemy wywnioskować, że fenol jest bardzo słabym kwasem, słabszym nawet od kwasu węglowego, który określany jest jako jeden ze słabszych kwasów nieorganicznych.
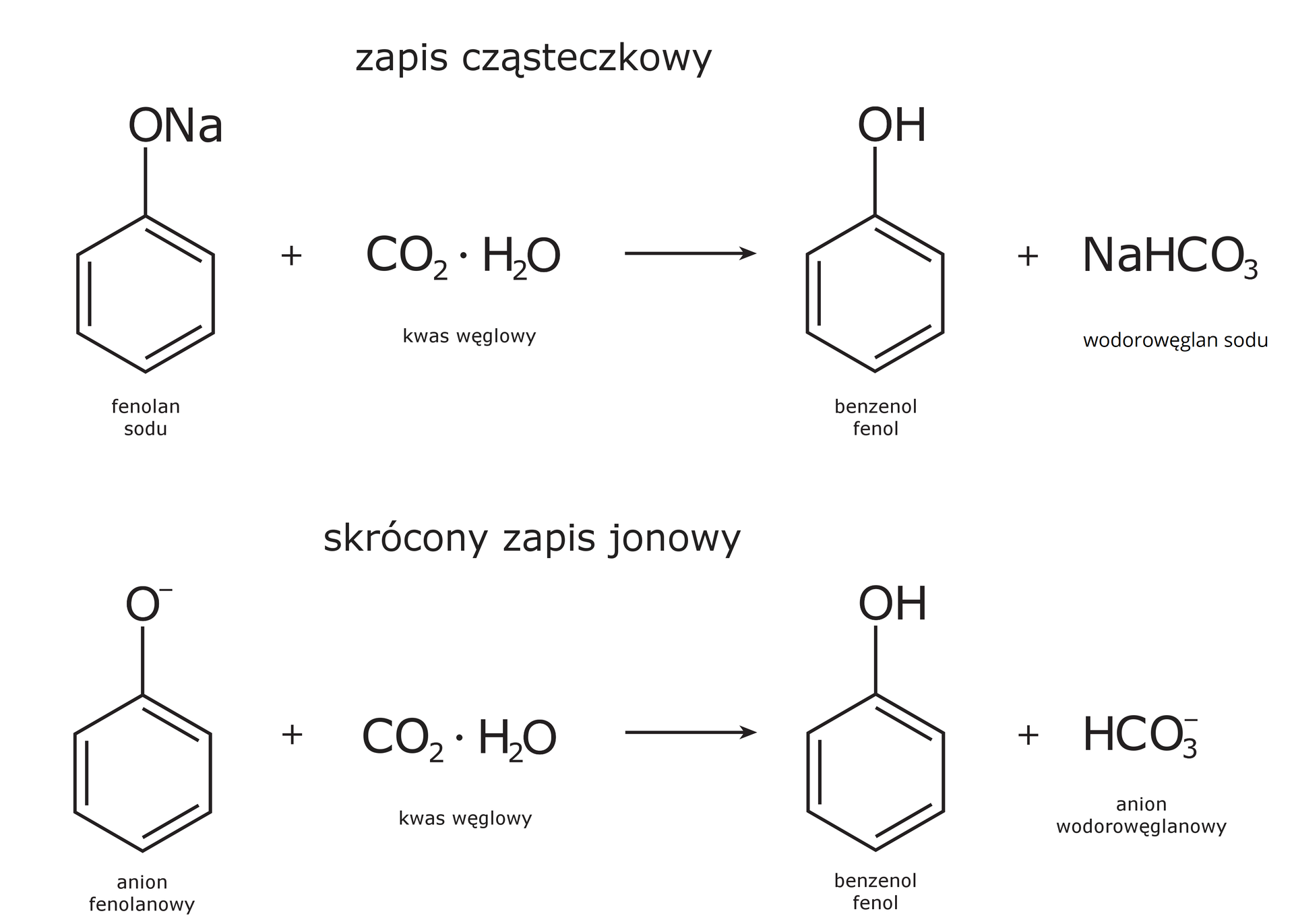
Wartość stałej dysocjacji fenolu jest mała, gdyż wynosi , co oznacza, że np. w roztworze o stężeniu jedna na cząsteczek fenolu ulega dysocjacji elektrolitycznej. Należy on do słabych elektrolitówsłabych elektrolitów. Warto podkreślić, że jest mocniejszym kwasem niż alkohole, ponieważ – w przeciwieństwie do nich – ulega reakcji z wodorotlenkiem sodu.
Przyczyna kwasowości fenolu
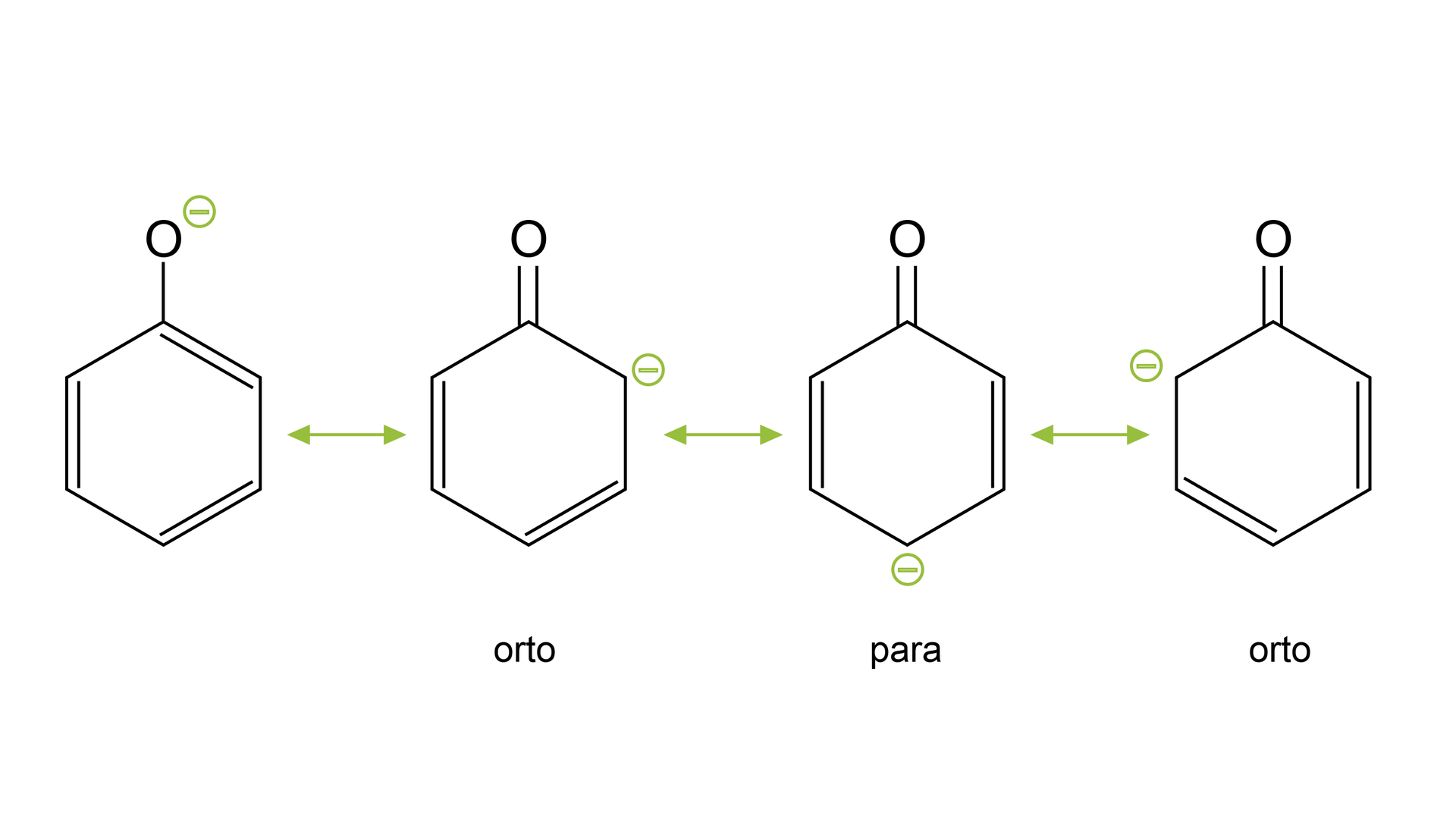
Właściwości kwasowe fenolu wynikają z obecności pierścienia aromatycznego w cząsteczce związku, który powoduje polaryzację wiązania między atomem tlenu a atomem wodoru w grupie hydroksylowej. Dochodzi do delokalizacji, czyli przemieszczenia ładunku ujemnego atomu tlenu na sąsiadujące atomy węgla w pierścieniu aromatycznym, co powoduje łatwiejsze oddanie protonu do cząsteczki fenolu. Skutkiem tego jest zwiększenie właściwości kwasowych fenolu i powstanie czterech możliwych struktur anionu fenolanowego. Ujemny ładunek może znajdować się na atomach węgla w pozycji ,- (orto) oraz ,- (para).
Podsumowanie
Fenol ulega dysocjacji elektrolitycznej.
Fenol jest bardzo słabym kwasem. Jest słabszy nie tylko od niektórych kwasów organicznych (mrówkowego oraz octowego), ale także od kwasu węglowego, ponieważ zostaje wyparty z roztworu soli tych kwasów.
Właściwości kwasowe fenolu wynikają z obecności pierścienia aromatycznego.
Słownik
(łac. dissociātiō „rozdzielenie”) rozpad substancji na jony pod wpływem rozpuszczalnika (najczęściej wody)
(gr. ḗlektron „bursztyn”, lytós „rozpuszczalny”) substancja, która w małym stopniu dysocjuje, np. kwas octowy
stała równowagi chemicznej procesu dysocjacji, charakterystyczna dla danego elektrolitu; jej wartość jest bezwymiarowa
Bibliografia
Bobrański B, Chemia organiczna, Warszawa 1992.
Buczek I., Chrzanowski M., Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Czerwiński A., Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 2. Podręcznik dla liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2003.
Danikiewicz W., Chemia. Związki organiczne. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa 2016.
Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne kompendium chemii, Warszawa 2007.
Majewski W., Mechanizmy reakcji chemicznych, Lublin 2012.
McMurry J., Chemia organiczna, tłum. H. Koroniak i in., t. 4, Warszawa 2003.
McMurry J., Chemia organiczna, tłum. H. Koroniak i in., t. 4, Warszawa 2004.
Pazdro K. M., Chemia Fundamenty. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa 2012.