Przeczytaj
Teorie atomistyczne i ich twórcy
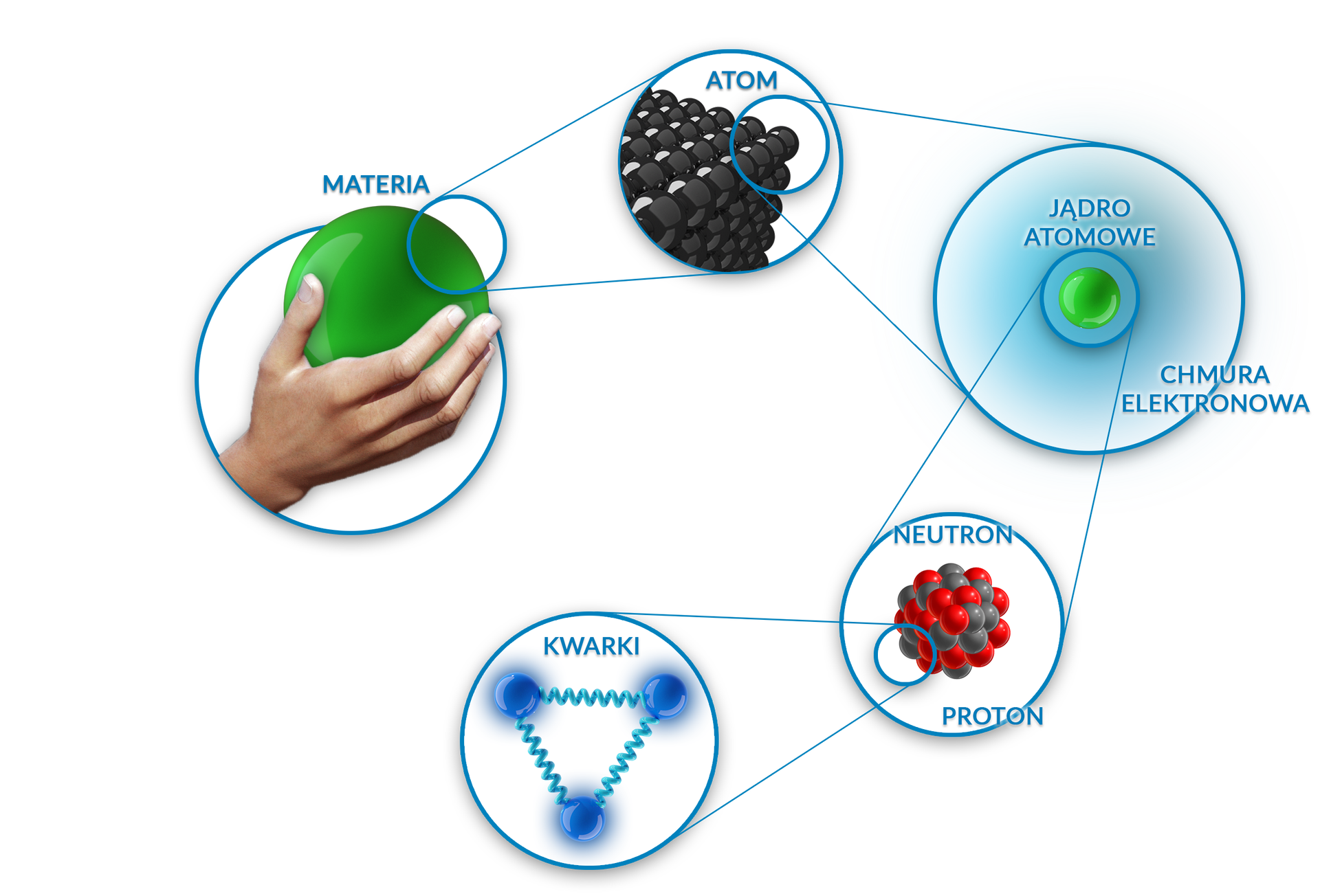
Ostatecznie, dokładna fizyczna natura atomów wyłoniła się z serii eksperymentów przeprowadzonych w latach 1895–1915. Jednym z najbardziej wyrazistych osiągnięć był słynny eksperyment rozpraszania promieniowania alfa, przeprowadzony w 1911 r. przez Ernesta Rutherforda. Ustalił, że prawie cała masa atomu jest zawarta w maleńkim (a zatem niezwykle gęstym) jądrze, które niesie dodatni ładunek elektryczny. Każdy element identyfikuje jego wartość i jest ona znana jako liczba atomowa pierwiastka.
Budowa jądra atomu
Centralną częścią każdego atomu jest jego jądro. Posiada ładunek dodatni, w przeciwieństwie do otaczających go ujemnie naładowanych elektronówelektronów. Jądro składa się z dwóch rodzajów cząstek.
Protony są nośnikami dodatniego ładunku elektrycznego w jądrze. Elektrony zaś mają ładunek przeciwny. Oznacza to, że w każdym (elektrycznie obojętnym) atomie liczba protonów w jądrze (często określana jako ładunek jądrowy) jest równoważona przez tę samą liczbę elektronów poza jądrem.
Drugą cząstką jądrową jest neutronneutron. Jak sama nazwa wskazuje, cząstka ta nie zawiera ładunku elektrycznego. Jego masa jest prawie taka sama jak masa protonu.
Do obserwacji atomów oraz ich elementów składowych potrzebna jest specjalistyczna aparatura, taka jak np. mikroskop elektronowy czy akceleratory.

W poniższej tabeli przedstawiono właściwości elektronów, protonów i neutronów.
Cząstka | Ładunek | Symbol | Masa [g] | Promień [m] |
|---|---|---|---|---|
elektron | -1 | eIndeks górny -- | 9,02·10Indeks górny -28-28 | mniej niż 10Indeks górny -18-18 |
proton | +1 | pIndeks górny ++ | 1,67·10Indeks górny -24-24 | 10Indeks górny -15-15 |
neutron | 0 | nIndeks górny 00 | 1,67·10Indeks górny -24-24 | 10Indeks górny -15-15 |
Wszystkie atomy danego pierwiastka mają taką samą liczbę protonów w swoim jądrze. Na przykład wszystkie atomy wodoru – gdziekolwiek we wszechświecie – mają jeden proton. Wszystkie atomy helu mają dwa protony. Wszystkie atomy tlenu mają osiem protonów.
Chemicy używają terminu liczba atomowa (symbol Z) w odniesieniu do liczby protonów w jądrze każdego atomu pierwiastka. Jak wiadomo, jądro atomu zawiera także neutrony. W rzeczywistości masa atomu wynika z połączonych mas jego protonów i neutronów. Dlatego liczba masowa elementu (symbol A) to całkowita liczba protonów i neutronów w jądrze jednego z jego atomów. Każdy proton lub neutron jest liczony jako jedna jednostka liczby masowej. Na przykład atom tlenu, który ma osiem protonów i osiem neutronów w swoim jądrze, ma liczbę masową 16. Atom uranu, który ma 92 protony i 146 neutronów, ma liczbę masową 238.
Informację o protonach i neutronach pierwiastka często podsumowuje się za pomocą notacji chemicznej, którą pokazano poniżej:
A - liczba masowa;
Z - liczba atomowa;
X - symbol pierwiastka.
Kwarki
Protony i neutrony posiadają wewnętrzną strukturę. W skład każdego z nich wchodzą trzy cząstki – kwarkikwarki. Istnieją tzw. trzy pokolenia kwarków: górne i dolne (pokolenie 1), dziwne i powabne (pokolenie 2), prawdziwe i piękne (pokolenie 3).
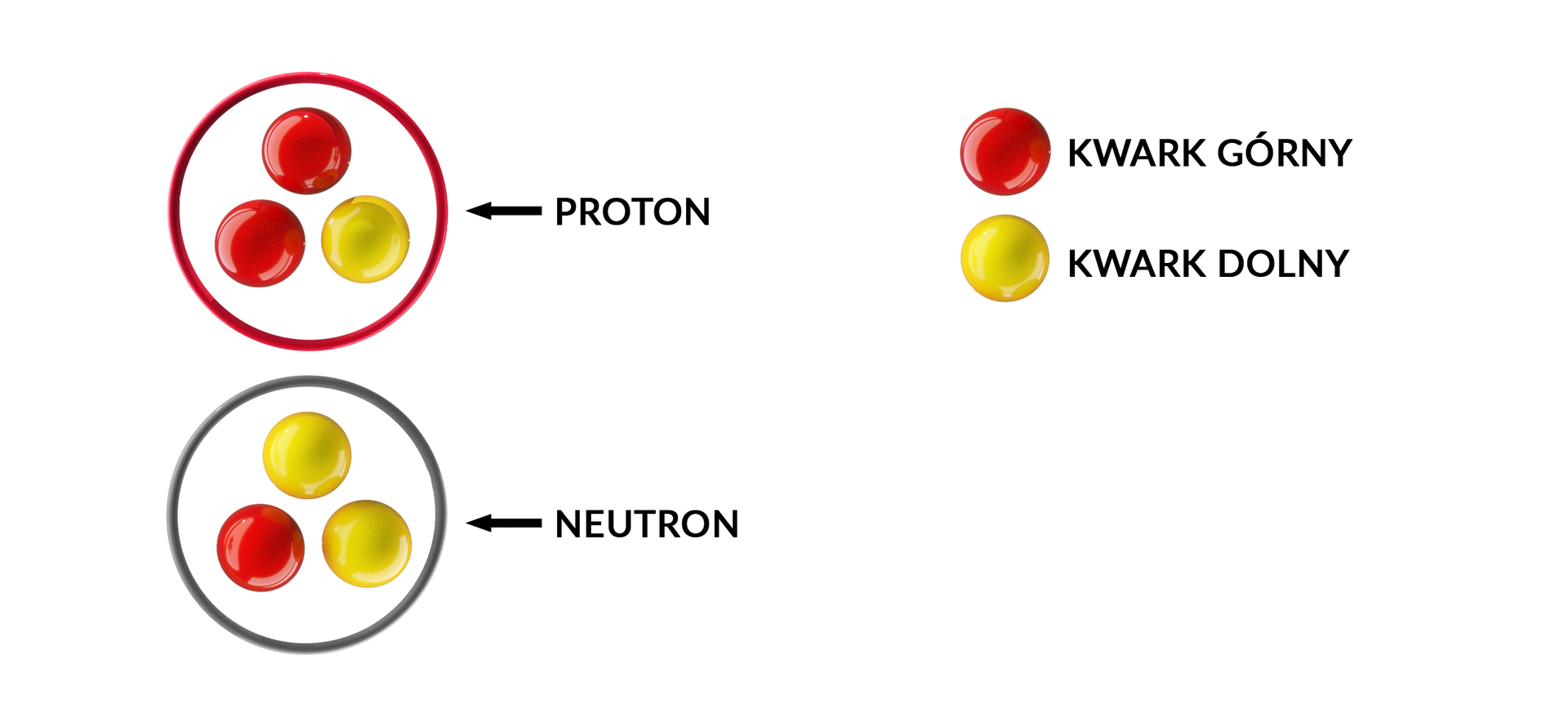
W skład zwykłej materii wchodzą jedynie kwarki górne i dolne. Proton złożony jest z trzech kwarków: dwóch górnych i jednego dolnego, a neutron z dwóch dolnych i jednego górnego. Kwarki górne mają ładunek dodatni +⅔ ładunku protonu, a kwarki dolne ładunek ujemny -⅓ ładunku protonu. Inne cząstki, które zawarte są we wnętrzu protonów i neutronów, to gluonygluony. Ich zadaniem jest utrzymywanie kwarków razem.
Antymateria
Większość cząstek elementarnych posiada również swoje odpowiedniki zwane antycząstkami. Antycząstki charakteryzują się takimi samymi cechami jak cząstki, ale mają przeciwny ładunek. Antyproton posiada ładunek ujemny, a antyelektron (pozyton) ma ładunek dodatni. W pewnych warunkach istnieje możliwość laboratoryjnego wytworzenia tych cząstek. Antyprotony wraz z otaczającymi ich pozytonami tworzą tzw. antymaterię.
Słownik
trwała cząstka zaliczana do grupy barionów; składnik jąder atomowych (obok neutronów)
(gr. ḗlektron „bursztyn’’) cząstka elementarna o masie
mIndeks dolny ee = 0,510998902(21) MeV/cIndeks górny 22 (tj. 9,10938188(72) · 10Indeks górny –31–31 kg) i ładunku elektrycznym
e = −1,602176462(63) · 10Indeks górny –19–19 C, występująca w dwóch stanach ładunkowych: jako ujemny – negaton, i dodatni – pozyton
elektrycznie obojętna cząstka z grupy barionów; składnik jąder atomowych (obok protonów)
wspólna nazwa protonów i neutronów, będących dwoma stanami dubletu izospinowego (izospin)
cząstki elementarne (fundamentalne), składniki protonów, neutronów i in. hadronów
cząstki elementarne przenoszące oddziaływania silne
w teoriach kwantowych liczby charakteryzujące stan stacjonarny układu, np. atomu, jądra atomowego lub cząstki elementarnej
Bibliografia
Atkins P., Jones L., Chemical Principles: The Quest for Insight, 5th Edition, New York 2009.
Encyklopedia PWN.
Myers R. T., Tocci S., Oldham K. B., Chemistry, USA 2006.
Saunders N., Saunders A., AS Chemistry, Oxford 2007.