Właściwości alkanów
Jedną z wykorzystywanych w życiu codziennym właściwości substancji jest palność. Na przykład metan to główny składnik gazu ziemnego. Jest wykorzystywany na co dzień do wytwarzania płomienia w kuchenkach gazowych, ogrzewania wody czy mieszkań. Niestety, co roku media informują o wybuchach metanu w kopalniach i śmierci z powodu zaczadzenia. Dlaczego tak się dzieje? Jakie jeszcze właściwości mają alkany i dlaczego ich spalanie może być niebezpieczne?
jaka jest konfiguracja elektronowa i położenie węgla w układzie okresowym;
jakie związki nazywamy węglowodorami nasyconymi;
jak zapisywać wzór sumaryczny alkanu o podanej liczbie atomów węgla;
jak tworzyć wzór ogólny szeregu homologicznego alkanów;
jak rysować wzory strukturalne i półstrukturalne alkanów.
wyjaśniać wpływ długości łańcucha węglowego na właściwości fizyczne alkanów, np. na stan skupienia;
planować doświadczenia pozwalające zbadać właściwości alkanów na przykładzie metanu i etanu;
obserwować i opisywać właściwości fizyczne i chemiczne (reakcje spalania) alkanów na przykładzie metanu i etanu.
1. Właściwości fizyczne alkanów
W jaki sposób można otrzymać metan?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Metan jest gazem o gęstości większej od gęstości powietrza i możemy go zbierać bezpośrednio do probówki lub zlewki, tak jak tlenek węgla(IV).
Metan jest gazem o mniejszej gęstości od powietrza i słabo rozpuszczalnym w wodzie, dlatego należy go zbierać do probówki lub zlewki napełnionej wodą i odwróconej do góry dnem w naczyniu napełnionym wodą.
3 g octanu sodu,
3 g tlenku wapnia,
3 g wodorotlenku sodu,
moździerz,
krystalizator,
2 probówki,
korek z rurką odprowadzającą,
korek,
statyw,
łapa,
palnik gazowy.
W moździerzu zmieszaj octan sodu, tlenek wapnia i wodorotlenek sodu.
Powstałą mieszaninę umieść w probówce, zamknij korkiem z rurką odprowadzającą i umocuj ukośnie w statywie.
Drugą probówkę napełnij wodą i umieść, odwróconą do góry dnem, w krystalizatorze napełnionym wodą do 1/3 objętości.
Zacznij ogrzewać probówkę z mieszaniną. Wydzielający się gaz zbieraj pod wodą do probówki (po ukończeniu zbierania zamknij probówkę korkiem).
Obserwuj zachodzące zmiany.
R10EU6Kb6Dek91  Źródło: Tomorrow Sp. z o.o., licencja: CC BY 3.0.
Źródło: Tomorrow Sp. z o.o., licencja: CC BY 3.0.
W wyniku reakcji powstaje bezbarwny, bezwonny gaz, który wypiera wodę z probówki. Bardzo trudno rozpuszcza się w wodzie. Zebranym gazem jest metan.
1. Przedstaw dane z tabeli 1., uwzględniając zależność liczby atomów węgla od temperatury wrzenia i topnienia w postaci wykresu słupkowego.
2. Odczytaj w tablicach chemicznych gęstość pierwszych pięciu węglowodorów z szeregu homologicznego alkanów.
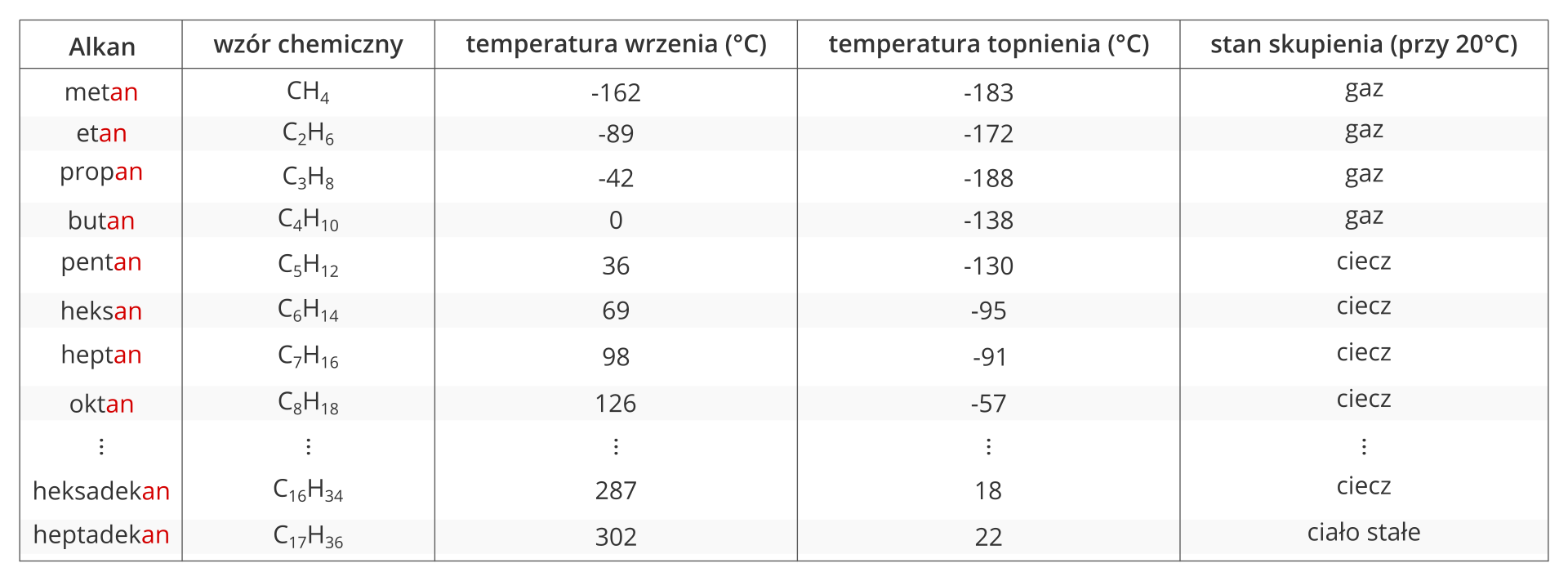
Właściwości fizyczne alkanów zmieniają się wraz ze wzrostem liczby atomów węgla w ich cząsteczkach – przechodzą od stanu gazowego, poprzez ciekły, do stanu stałego.
Alkany są związkami bezbarwnymi, o małej gęstości, nie rozpuszczają się w wodzie. Alkany zawierające w cząsteczce od 1 do 4 atomów węgla w cząsteczce to gazy. Węglowodory nasycone zawierające od 5 do 16 atomów węgla w cząsteczce to ciecze, a mające 17 i więcej atomów węgla w cząsteczce – substancje stałe.

2. Właściwości chemiczne alkanów
Doświadczenie należy przeprowadzać w okularach ochronnych.
Czy metan jest gazem palnym?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Metan jest gazem palnym.
Metan nie jest gazem palnym.
palnik gazowy,
zlewka,
woda wapienna,
szczypce.
Zapal palnik gazowy, za pomocą pokrętła ustaw najpierw mały, a następnie duży dostęp powietrza.
Nad palnikiem trzymaj zlewkę zwilżoną wodą wapienną.
Do wylotu palnika zbliż szkiełko zegarkowe, ograniczając dopływ powietrza.
Obserwuj zachodzące zmiany.

Głównym składnikiem gazu ziemnego jest metan. Jest on gazem palnym. Przy nieograniczonym dostępie powietrza spala się bladoniebieskim płomieniem. Powstaje wtedy para wodna, a w miejscu zwilżenia wodą wapienną widać biały osad, co oznacza, że jednym z produktów spalania jest tlenek węgla(IV). Przy ograniczonym dostępie powietrza (tlenu) płomień przyjmuje żółtą barwę, a na szkiełku pojawia się czarny nalot – sadza.
Reakcję spalania całkowitegospalania całkowitego opisuje równanie:

Przy ograniczonym dostępie powietrza zachodzi spalanie niecałkowitespalanie niecałkowite:


Film dostępny na portalu epodreczniki.pl
Animacja przedstawiająca reakcję spalania całkowitego metanu. Wykonywane są obliczenia obrazujące tę reakcję.
W wyniku niecałkowitego spalania metanu, np. w piecykach gazowych, powstaje tlenek węgla(II) zwany czadem. Jest to bezbarwny, bezwonny gaz, który w organizmie człowieka ok. 300 razy szybciej łączy się z hemoglobiną niż tlen.
Tworzy on połączenie, które jest trwalsze niż połączenie tlenu z hemoglobiną. Dochodzi więc do niedotlenienia tkanek, co w wielu przypadkach prowadzi do śmierci. Jedynym ratunkiem jest natychmiastowa transfuzja krwi.
W pomieszczeniach, w których występuje ryzyko emisji tlenku węgla(II), montuje się detektory przeznaczone do stałej kontroli obecności tego gazu. Po przekroczeniu określonych wartości stężenia tlenku węgla(II) w powietrzu zostaje uruchomiony odpowiedni sygnał.

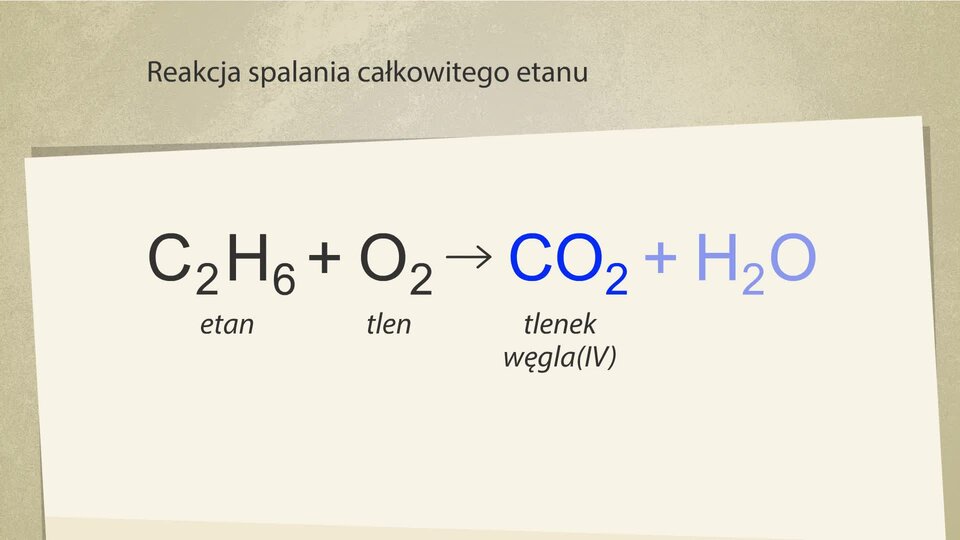
Produktami spalania całkowitego innych alkanów są – tak jak w przypadku metanu – tlenek węgla(IV) i woda. Natomiast podczas spalania niecałkowitego powstają odpowiednio tlenek węgla(II) i woda lub węgiel i woda.
W wyniku spalania całkowitego etanu powstaje zatem:

Film dostępny na portalu epodreczniki.pl
Animacja przedstawiająca reakcję spalania całkowitego etanu gdzie są uzgadniane wartości po stronie substratów i produktów.
Przy ograniczonym dostępie tlenu zachodzi spalanie niecałkowite:


Film dostępny na portalu epodreczniki.pl
Prezentowane są odpowiednio wymieniane sprzęty laboratoryjne i odczynniki. Eksperymentator wlewa do krystalizatora wodę, dodaje detergent. Eksperymentator wprowadza wężykiem gaz z butli do krystalizatora z wodą. Na powierzchni krystalizatora tworzą się bańki. Po zebraniu większej ilości baniek eksperymentator odstawia butlę. Eksperymentator zbliża do baniek zapalone łuczywko. Pojawia się duży płomień.
Mieszanina metanu z powietrzem w stężeniu objętościowym 4,5–15% ma właściwości wybuchowe. Tworzenie się tej mieszaniny wskutek przedostania się metanu do zamkniętych pomieszczeń bywa przyczyną groźnych w skutkach eksplozji, zarówno w budynkach mieszkalnych, jak i kopalniach. W mieszaninie o proporcji powyżej 15% metan pali się płomieniowo. Mieszanina wybuchowa eksploduje np. pod wpływem ognia czy iskry elektrycznej. Dlatego gdy podejrzewasz, że ulatnia się gaz, zamknij jego dopływ i otwórz szeroko okna. Pod żadnym pozorem nie zapalaj ognia ani nie włączaj urządzeń elektrycznych. Jak naszybciej opuść mieszkanie i zawiadom pogotowie gazowe (tel. 992).

Doświadczenie należy przeprowadzać w okularach ochronnych.
Czy węglowodory ciekłe i stałe są palne?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Węglowodory stałe i ciekłe są palne.
Węglowodory stałe i ciekłe nie są palne.
palnik gazowy,
2 parownice,
nafta lub pentan,
parafina,
szczypce,
trójnóg,
siatka ze spiekiem ceramicznym,
łuczywo.
W ogrzanej parownicy umieść niewielką ilość pentanu (lub nafty). Zapal go (ją), używając łuczywa.
Umieść parownicę z niewielką ilością parafiny na trójnogu z siatką ceramiczną i ogrzewaj. Po chwili zapal ją, używając łuczywa.
Obserwuj zachodzące zmiany.
Nafta jest mieszaniną ciekłych, a parafina – stałych węglowodorów. Po ogrzaniu nafty jej pary zapaliły się. Podobnie było w przypadku parafiny – stopiła się, a jej pary zapaliły się. Wszystkie alkany są palne, a temperatura zapłonu wzrasta z liczbą atomów węgla w cząsteczce węglowodoru.


Film dostępny na portalu epodreczniki.pl
Animacja prezentuje sposób obliczania wzoru sumarycznego i nazwy alkanu na podstawie masy cząsteczkowej, lektor kolejno objaśnia kolejne kroki jakie należy wykonać w ćwiczeniu, a na ekranie wyświetlane są kolejne obliczenia.
Badanie zachowania się metanu w obecności wodnego roztworu wody bromowej.

Film dostępny na portalu epodreczniki.pl
Na ekranie widać konieczne do przeprowadzenia eksperymentu sprzęty i substancje. Po wypowiedzeniu przez lektora kolejnych poleceń prezentowane jest ich wykonanie. Czynności eksperymentatora: do pierwszej probówki wlewamy do 1/3 jej objętości roztworu bromu (wody bromowej).Drugą probówkę napełniamy metanem i wlewamy taką samą objętość bromu (wody bromowej). Probówkę zamykamy korkiem i mieszamy przez wytrząsanie. Zbliżenie na obie probówki.
Pod wpływem wysokiej temperatury lub światła metan reaguje m.in. z bromem i chlorem.
Czy propan i butan odbarwiają roztwór manganianu(VII) potasu?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Propan i butan nie odbarwiają roztworu manganianu(VII) potasu.
Propan i butan odbarwiają roztwór manganianu(VII) potasu.
2 probówki,
korek,
rozcieńczony roztwór manganianu(VII) potasu,
mieszanina propanu i butanu (np. gaz do napełniania zapalniczek).
Do pierwszej probówki wlej do 1/3 jej objętości rozcieńczony roztwór manganianu(VII) potasu.
Drugą probówkę napełnij mieszaniną propanu i butanu Następnie wlej taką samą ilość roztworu manganianu(VII) potasu. Probówkę zamknij korkiem i dobrze wymieszaj przez wytrząsanie.
Obserwuj zachodzące zmiany.
Porównaj zawartość obu probówek.

Mieszanina propanu i butanu nie odbarwia roztworu manganianu(VII) potasu, czyli z nim nie reaguje. Węglowodory nasycone są mało reaktywne. Wynika to z ich budowy i obecności w cząsteczce wiązań pojedynczych, które są trudne do rozerwania.
Podsumowanie
Właściwości fizyczne alkanów zmieniają się wraz ze wzrostem długości łańcucha węglowego.
Alkany są związkami mało reaktywnymi chemicznie, w temperaturze pokojowej ulegają reakcjom spalania.
Określ stan skupienia związków chemicznych o wzorach: , , , .
Narysuj wzór strukturalny i półstrukturalny alkanu, którego masa cząsteczkowa wynosi 100 u.
Przedstaw w formie plakatu informacje na temat postępowania w przypadku nieszczelności instalacji gazowej.
Słowniczek
proces spalania węglowodorów przy nieograniczonym dostępie powietrza (tlenu); jego produktami są tlenek węgla(IV) i woda
proces spalania węglowodorów przy ograniczonym dostępie powietrza (tlenu); jego produktami są tlenek węgla(II) (czad) oraz woda lub węgiel (sadza) i woda
Zadania
Rozwiąż zadanie.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D6pTjIwIF
Uzupełnij równanie reakcji opisującej przebieg niecałkowitego spalania pewnego węglowodoru nasyconego. W wyniku tego procesu nie powstaje czad. Wstaw wzory związków i pierwiastków chemicznych oraz współczynniki stechiometryczne we właściwe miejsca.
, , , 5, 4, 3, , , 2, 6, 7, ,
............ + ............ ............ + ............ ............
Na podstawie tabeli oceń prawdziwość podanych informacji. Wskaż, które zdanie jest prawdziwe, a które fałszywe.
Alkan | Wzór chemiczny | Temperatura wrzenia (°C) | Temperatura topnienia (°C) | Stan skupienia (przy 20°C) |
Metan | -162 | -183 | gaz | |
Etan | -89 | -172 | gaz | |
Propan | -42 | -188 | gaz | |
Butan | -138 | gaz | ||
Pentan | 36 | -130 | ciecz | |
⁞ | ||||
Heksadekan | 287 | 18 | ciecz | |
Heptadekan | 302 | 22 | ciało stałe |
| Prawda | Fałsz | |
| Wraz ze wzrostem liczby atomów węgla w cząsteczce alkanów maleje temperatura wrzenia. | □ | □ |
| Wraz ze wzrostem liczby atomów węgla w cząsteczce alkanów wzrasta temperatura wrzenia. | □ | □ |
| Wraz ze wzrostem liczby atomów węgla w cząsteczce alkanów maleje temperatura topnienia. | □ | □ |
| Wraz ze wzrostem liczby atomów węgla w cząsteczce alkanów wzrasta temperatura topnienia. | □ | □ |
| Pentan w temperaturze 20°C jest gazem. | □ | □ |