Przeczytaj
Warto przeczytać
Zasada zachowania energii
Zasada zachowania energii mówi, że w całkowita energia układu zamkniętego nie zmienia się w czasie.
Jest to zasada empiryczna, czyli oparta na doświadczeniu. Nigdy, w żadnym eksperymencie czy obserwacji, nie stwierdzono złamania tej zasady. Z zasady zachowania energii wynika, że energia nie może znikać, ani pojawiać się, a tylko jedna jej forma przemienia się w inną.
Jedną z form energii jest energia promieniowania elektromagnetycznego, które ma dwoistą naturę – jest jednocześnie falą i zbiorem fotonów. Energia promieniowania jest skwantowana. Najmniejsza porcja energii promieniowania, kwantkwant energii, jest energią jednego fotonu. Fotony mogą znikać lub pojawiać się, ale jest to zawsze związane ze zmianą energii innego obiektu. Przykładem jest emisja lub absorpcja fotonu przez atom. W procesach tych zmienia się energia atomu, ale dzieje się to w taki sposób, że energia całkowita układu: atom + foton jest zachowana. Aby zrozumieć mechanizm emisji i absorpcji promieniowania przez atomy, trzeba poznać budowę atomu.
Budowa atomu
Atom składa się z protonów i neutronów tworzących jądro atomowe o dodatnim ładunku, które otaczają ujemnie naładowane elektrony. Średnica jądra atomowego jest około 100 tysięcy razy mniejsza od średnicy atomu, ale prawie cała masa atomu skupiona jest w jądrze (Rys. 1.). Atomu nie można opisać pojęciami fizyki klasycznej. Do opisu mikroświata stosuje się mechanikę kwantową, która traktuje poruszające się cząstki jako fale, których częstotliwość jest wprost proporcjonalna do energii cząstki. Wiemy, że w ograniczonej przestrzeni mogą powstawać tylko fale stojące. Na przykład w strunie gitary powstaje fala stojąca o określonych częstotliwościach, zależnych od długości struny (zob. materiał pt. Fale stojące). Podobnie jest z elektronem uwięzionym w atomie. Z równań mechaniki kwantowej wynika, że energia elektronu w atomie może przybierać tylko pewne określone wartości. Nazywamy je dozwolonymi poziomami energetycznymi.
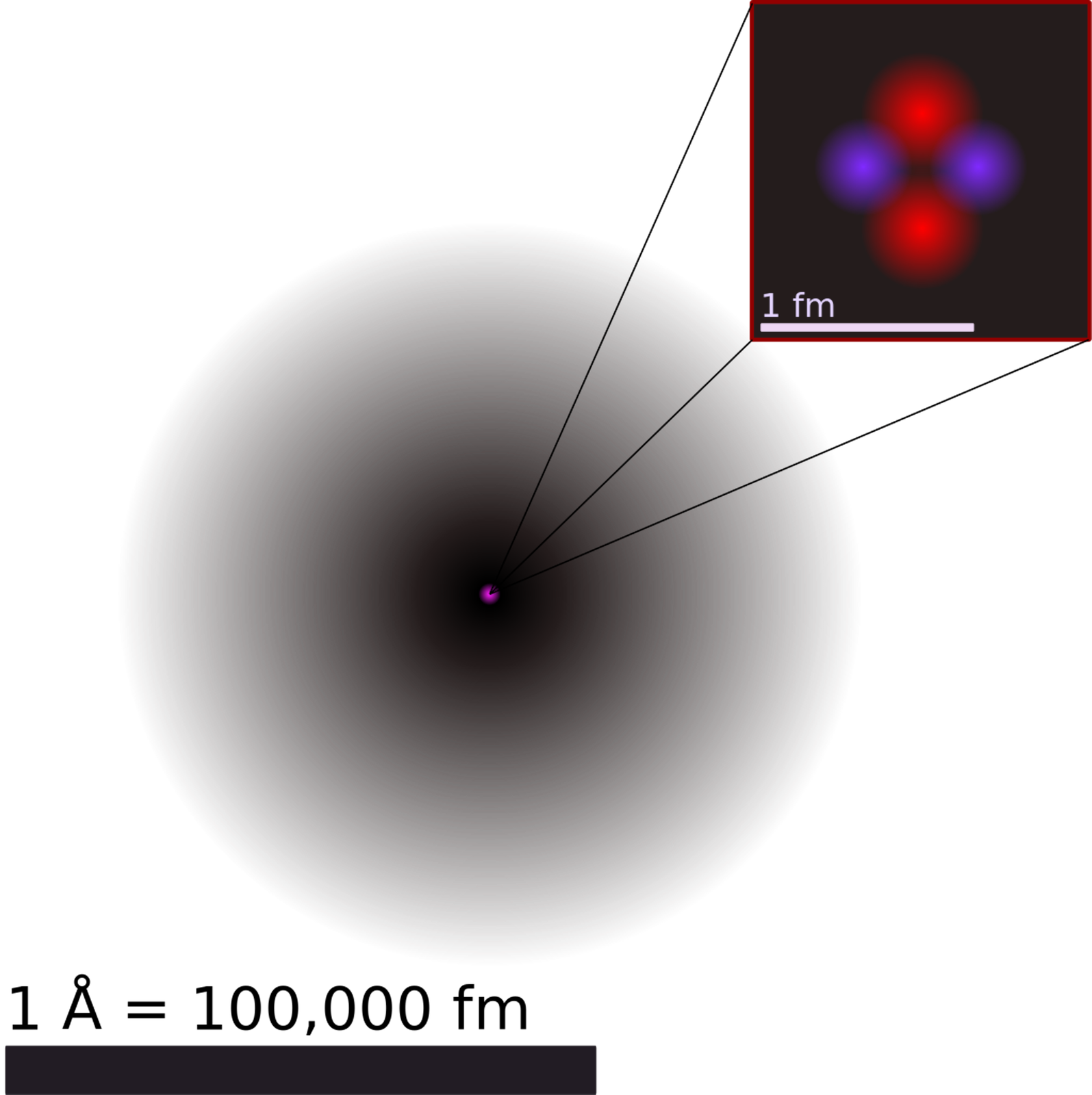
Co to oznacza, że jądro atomowe jest sto tysięcy razy mniejsze od średnicy całego atomu? Aby uzmysłowić sobie różnice w wielkościach różnych składników atomu posłużymy się nieco żartobliwym, ale bardzo pouczającym, „sportowym modelem atomu”. Przyjmijmy, że stadion ma długość jednego kilometra, czyli jest to stadion‑gigant (długość Stadionu Narodowego w Warszawie nie przekracza 500 m). Coś, co jest sto tysięcy razy mniejsze ma wtedy średnicę 1 cm. Jeśli więc atom zostałby powiększony do rozmiarów takiego gigantycznego stadionu, to jego jądro atomowe miałoby rozmiar ... drażetki M&M'sa (Rys. 2.).

Elektron przechodzi z jednego poziomu energetycznego na inny skokowo. Jego energia nie zmienia się w sposób ciągły, podobnie jak człowiek wchodzący lub schodzący po drabinie zmienia swoją energię potencjalną grawitacji skokowo (nie może zatrzymać się między szczeblami).
Atom wodoru
Najprostszym atomem jest atom wodoru, który składa się z jednego protonu w jądrze atomowym i jednego elektronu na orbicie. Dozwolone energie elektronu w atomie wodoru wyrażają się wzorem
gdzie to liczba naturalna ( = 1, 2, 3, 4, … ).
Liczbę nazywa się też główną liczbą kwantową, która wyznacza kolejne powłoki elektronowe. Każdej powłoce elektronowej odpowiada inny poziom energetyczny. Poziomy energetyczne elektronu w atomie wodoru przedstawione są na Rys. 3. Energie elektronu w atomie przyjmują wartości ujemne. Gdy atom ma najmniejszą możliwą energię, jest w stanie podstawowym, wszystkie wyższe poziomy energetyczne to stany wzbudzone. Energia stanu podstawowego atomu wodoru wynosi -13,6 eVeV. Aby oderwać elektron od atomu, znajdującego się w stanie podstawowym, trzeba dostarczyć mu energię wystarczającą na to, aby energia elektronu zwiększyła się co najmniej do zera. Elektron o energii większej lub równej zero jest już elektronem swobodnym i jego energia może zmieniać się w sposób ciągły. Najmniejsza energia, która powoduje oderwanie elektronu od atomu nosi nazwę energii jonizacji. Dla atomu wodoru wynosi ona 13,6 eV.

Zasada zachowania energii dla atomu wodoru
Gdy elektron przeskakuje z wyższego poziomu energetycznego na niższy, jego energia zmniejsza się. Utracona przez elektron energia zamienia się na energię fotonu, który jest emitowany przez atom. Energia wyemitowanego fotonu jest równa różnicy między energią początkową i końcową elektronu (Rys. 4. A).
Możliwy jest także odwrotny proces. Jeśli do atomu zbliży się foton o energii dokładnie równej różnicy między energiami poziomów energetycznych, może on zostać pochłonięty przez ten atom. W takiej sytuacji foton znika, a jego energia, zgodnie z zasada zachowania energii, zwiększa energię elektronu w atomie – elektron przeskakuje na wyższy poziom energetyczny (Rys. 4. B).
Zarówno podczas emisji, jak i absorpcji fotonu przez atom, spełniona jest zasada zachowania energii, wyrażona wzorem:
gdzie jest energią fotonu wyemitowanego lub pochłoniętego przez atom, – wyższą energią elektronu, – niższą energią elektronu podczas przejścia między poziomami energetycznymi.

Energia fotonu związana jest z częstotliwością i długością fali promieniowania elektromagnetycznego wzorem
gdzie jest częstotliwością fali, jej długością, oznacza prędkość światła, a jest stałą Plancka.
Korzystając z równań (2) i (3) możemy wyznaczyć częstotliwość promieniowania emitowanego lub absorbowanego przez atom:
czyli
Wyznaczmy częstotliwość promieniowania, emitowanego przez atom wodoru podczas przeskoku elektronu z poziomu energetycznego na poziom , oraz z poziomu na .
Korzystając ze wzoru (1) na energię elektronu w atomie wodoru otrzymujemy: , oraz .
Podczas przeskoku elektronu z poziomu energetycznego = 5 na poziom = 1, częstotliwość wyemitowanego fotonu wynosi:
Promieniowanie to leży w zakresie nadfioletu, którego częstotliwość zawiera się w granicach (10Indeks górny 1515 – 8 · 10Indeks górny 1515) Hz.
Podczas przeskoku elektronu z poziomu energetycznego na poziom , częstotliwość wysłanego promieniowania wynosi:
Promieniowanie o takiej częstotliwości leży w podczerwieni (6,7 · 10Indeks górny 99 – 4,3 · 10Indeks górny 1414) Hz.
Z tego przykładu widać, że atom wodoru emituje, a także absorbuje, fotony w bardzo szerokim zakresie częstotliwości od podczerwieni do nadfioletu. Większe atomy, których jądra zawierają wiele protonów wytwarzają silniejsze pole elektryczne niż atom wodoru z jednym protonem w jądrze. W takich atomach elektrony wewnętrznych powłok elektronowych są silniej związane, co oznacza, że ich energia ma mniejszą wartość, niż w przypadku elektronu w atomie wodoru. Dlatego przeskoki elektronów na wewnętrzne powłoki elektronowe w dużych atomach powodują emisję fotonów z zakresu promieniowania rentgenowskiego, o częstotliwości jeszcze większej niż częstotliwość fotonów w nadfiolecie.
Jeśli atomy oświetlimy promieniowaniem o różnych częstotliwościach, pochłonięte mogą być tylko te fotony, których energie równe są różnicom między stanami energetycznymi w atomach. Pozostałe fotony przelecą bez przeszkód, atomy są dla nich przezroczyste, ponieważ nie istnieją stany energetyczne atomów, które mogłyby być stanem końcowym po absorpcji takich fotonów. Dotyczy to jednak tylko fotonów o energii mniejszej od energii jonizacji. Gdy energia fotonów padających na atom przewyższa energię jonizacji, każdy z nich może być zaabsorbowany przez atom. W takim przypadku energia pochłoniętego fotonu zamienia się na pracę potrzebną do wyrwania elektronu z atomu (równą energii jonizacji) oraz na energię kinetyczną, z jaką elektron oddala się od atomu:
Słowniczek
(ang.: electronvolt) – jednostka energii spoza układu SI używana w fizyce mikroświata. 1 eV to energia, jaką uzyskuje elektron przyspieszany w polu elektrycznym o różnicy potencjałów równej 1 wolt. 1 eV = 1,6 · 10Indeks górny -19-19 J.
(ang.: quantum) – najmniejsza porcja danej wielkości fizycznej. Kwantem promieniowania elektromagnetycznego jest foton. O wielkości fizycznej mówimy, że jest skwantowana, jeśli może przyjmować tylko określone wartości.