Przeczytaj
Jednym z typów wodorosoliwodorosoli są sole, których aniony reszty kwasowej zawierają jeden (lub więcej) atomów wodoru. Wśród tego typu związków wyróżnia się:
wodorowęglany – zawierają resztę kwasową ,
wodorosiarczany(VI) – zawierają resztę kwasową ,
wodorofosforany(V) – zawierają resztę kwasową ,
diwodorofosforany(V) – zawierają resztę kwasową .
Wartościowości takich reszt kwasowych są równe co do ilości liczby atomów wodoru, które zostały odłączone od cząsteczki kwasu. A więc reszta kwasowa jest jednowartościowa, ponieważ do jej uzyskania od kwasu siarkowego(VI) () odłączono jeden atom wodoru. Wyżej wymienione reszty kwasowe, zawierają co najmniej jeden atom wodoru i dlatego nazywane są resztami kwaśnymi.
Czym jest wartościowość?
WartościowośćWartościowość to cecha pierwiastków chemicznych oraz jonów, określająca liczbę wiązań chemicznych, którymi dany pierwiastek lub jon może się łączyć z innymi. Właściwość ta wynika z budowy chmury elektronowej atomu i jest pojęciem nieprecyzyjnym, ponieważ nie uwzględnia chemicznego otoczenia, jakie posiada dany atom.
Jak tworzy się wzory sumaryczne wodorosoli?
Ogólny wzór wodorosoli ma postać:
Gdzie:
– jon metalu (lub jon amonu),
– oznacza wartościowość metalu,
– reszta kwasowa,
– oznacza wartościowość reszty kwasowej ,
– oznacza liczbę wodorów pozostałą przy reszcie kwasowej,
– oznacza wartościowość jonu :
Wzory wodorosoli tworzy się analogicznie, jak wzory innych soli, stosując w tym celu regułę krzyżową.
Ustalanie wzoru sumarycznego wodorosoli na podstawie nazwy
Podaj wzór sumaryczny wodorowęglanu wapnia.
Zapisz wzór reszty kwasowej i podaj jej wartościowość (wartościowość reszty kwasowej możesz określić na podstawie współczynnika liczbowego przy wodorze):

Posługując się wzorem ogólnym wodorosoli, dokonaj zapisu tej wodorosoli i zaznacz wartościowość metalu:
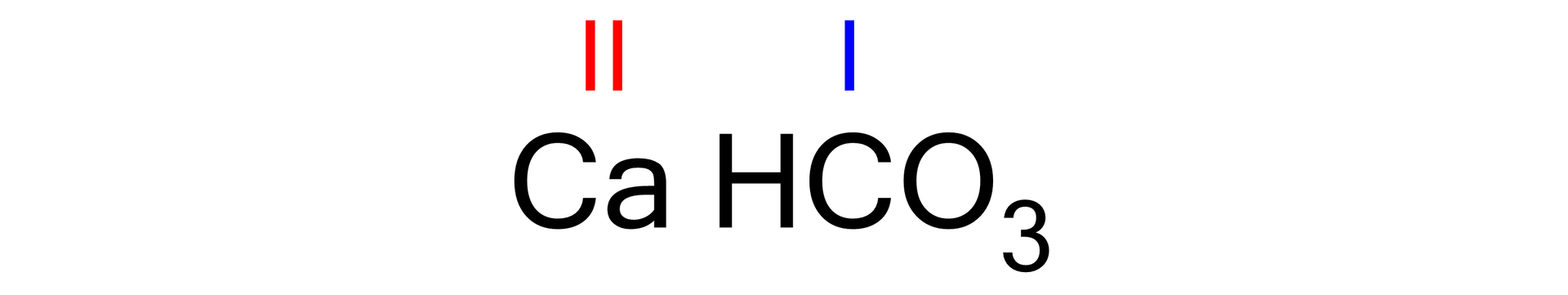
Korzystając z wartościowości kationu i anionu, zastosuj regułę krzyżową:

Wpisz indeksy dolne przy kationie i anionie (pamiętając jednocześnie, że 1 nie musimy wpisywać). W rezultacie otrzymasz wzór w postaci:
Ustalanie nazwy wodorosoli na podstawie wzoru sumarycznego
Podaj nazwę wodorosoli, której wzór sumaryczny ma postać .
Zapisz wzór i nazwę reszty kwasowej oraz podaj jej wartościowość:
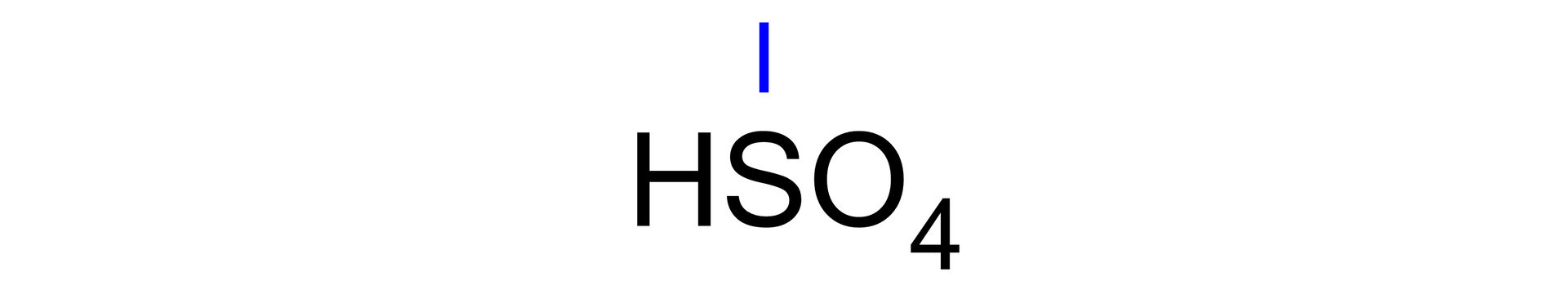
Następnie podaj wartościowość potasu i zapisz wzór sumaryczny:

Sprawdź, czy potas przyjmuje w związkach wyłącznie wartościowość I, jeśli tak – nie musisz jej uwzględniać w nazwie; w przeciwnym wypadku należy uwzględnić jego wartościowość w nazwie:
Potas przyjmuje wyłącznie wartościowość I.
Podaj nazwę wodorosoli:
Nazwa soli to wodorosiarczan(VI) potasu.
Otrzymywanie wodorosoli
Wodorosole można otrzymać w wyniku reakcji kwasów wieloprotonowychkwasów wieloprotonowych z tlenkami metali, zasadami lub metalami, przy zastosowaniu stechiometrii, która nie odpowiada reakcji całkowitego zobojętnienia. Na przykład, jeśli zasady jest za mało w stosunku do kwasu, nie cały kwas ulegnie reakcji.
Kwas wieloprotonowy + zasada:
Kwas wieloprotonowy + tlenek metalu:
Kwas wieloprotonowy + metal:
Możliwe jest również otrzymanie wodorosoli w wyniku reakcji kwasu (nie musi on posiadać takiej samej reszty kwasowej jak sól) z solą obojętnąsolą obojętną:
Wodorosole mogą ulegać reakcji dysocjacji, przykładowo wodorosiarczan(VI) sodu ulega jej jak pokazano poniżej:
Powstały w wyniku dysocjacji anion wodorosiarczanowy(VI) może dalej dysocjować (cecha mocnych kwasów):
Jednak jeśli mamy do czynienia z wodorosolami słabych kwasów (np. kwasu siarkowego(IV)), to powstały w wyniku dysocjacji anion kwasowy:
Może ulegać hydrolizie:
a także dysocjacji:
Jako, że kwas siarkowy(IV) jest kwasem słabym to proces hydrolizy zachodzi w większym stopniu niż proces dysocjacji.
Nazwa wodorosoli | Wzór wodorosoli | Stopień utlenienia | Wartościowość reszty kwasowej |
|---|---|---|---|
Wodorowęglan sodu | I | I | |
Wodorowęglan wapnia | II | I | |
Wodorosiarczan(VI) potasu | I | I | |
Wodoroortofosforan(V) wapnia | II | II | |
Wodoroortofosforan(V) sodu | I | II | |
Diwodoroortofosforan(V) magnezu | II | I | |
Diwodoroortofosforan(V) potasu | I | I | |
Triwodoroortokrzemian litu | I | I | |
Wodoroortofosforan(V) glinu | III | II | |
Diwodoroortofosforan(V) glinu | III | I | |
Wodorsiarczan(VI) glinu | III | I |
Tabela przedstawia przykładowe wodorosole o różnych stopniach utlenienia metali i wartościowościach reszt kwasowych.
Właściwości i zastosowanie wodorosoli
Wodorosole cechują się znacznie lepszą rozpuszczalnością od odpowiadających im soli obojętnych. Czego dobrym przykładem jest trudno rozpuszczalna sól w postaci węglanu wapnia () i jej uwodorniony odpowiednik w postaci bardzo dobrze rozpuszczalnego wodorowęglanu wapnia () – spotykany w wodzie wodociągowej, a także odpowiedzialny za przemijającą twardość wody. Stalagmity i stalaktyty w jaskiniach Jury Krakowsko‑Częstochowskiej powstają m.in. z wodorowęglanu wapnia, który tworzy nierozpuszczalne osady węglanu wapnia, co przedstawia poniższa reakcja:
Dobra rozpuszczalność wodorowęglanów spowodowała, że znalazły one zastosowanie m.in. jako nawozy sztuczne. Superfosfat – popularny nawóz – składa się z diwodorofosforanu(V) wapnia i stanowi źródło łatwo przyswajalnego fosforu i wapnia dla roślin. Otrzymuje się go w wyniku zalania zmielonej skały fosforytowej kwasem siarkowym(VI):
Innym związkiem stosowanym jako nawóz do roślin akwariowych jest diwodoroortofosforan(V)potasu . Do pieczenia ciast stosuje się proszek do pieczenia, a jego głównym składnikiem jest – wodorowęglan amonu, który podczas pieczenia ulega rozkładowi wydzielając gazy, dzięki czemu ciasto unosi się ku górze. Jednym ze składników rozkładu jest amoniak, dlatego ważne jest, aby przed zjedzeniem wypieków poczekać, aż ciasto ostygnie – wówczas amoniak zdąży się ulotnić.
Soda oczyszczona – wodorowęglan sodu – stosowana jest do mycia przypalonych naczyń oraz do pieczenia (należy jednak pamiętać o dodaniu czegoś zawierającego kwas).
Słownik
(niem. wertigkeit) oznacza liczbę wiązań chemicznych, jaką dany jon lub pierwiastek może tworzyć z innymi pierwiastkami; wartościowość jest pojęciem stricte teoretycznym
związki chemiczne, zwane solami kwaśnymi, które pochodzą od kwasów wielowodorowych; powstają w wyniku niepełnego zastąpienia atomów wodoru metalem (lub jonem amonowym)
jest to sól, która w swojej budowie nie zawiera ani kationów wodoru ani anionów wodorotlenkowych, np. chlorek potasu,
to kwas, który zawiera dwa lub więcej atomów wodoru mogących ulec odszczepieniu w wyniku procesu dysocjacji
Bibliografia
Encyklopedia PWN
Kaznowski K., Pazdro K. M., ABC chemii. Podręcznik do gimnazjum., Część A. Ziarnistość materii, Warszawa, online: https://pazdro.com.pl/uploads/files/ABC_Informator_internet.pdf, dostęp: 24.03.2021.