Przeczytaj
Czym jest chromatografia?
ChromatografiaChromatografia jest metodą rozdziału i analizy substancji chemicznych. Polega ona na rozdzieleniu składników jednorodnej mieszaniny między fazę ruchomą a nieruchomą układu chromatograficznego w wyniku ich różnego podziału. Dzięki niej możemy analizować zarówno pojedyncze związki (aminokwasyaminokwasy, cukrycukry), jak i złożone mieszaniny: próbki krwi, próbki środowiskowe. Proces chromatografii opiera się na prawie podziału Nernstaprawie podziału Nernsta, które mówi nam o podziale substancji między dwie niemieszające się fazy.
W przypadku chromatografii jest to faza stacjonarna i faza ruchoma. Można przedstawić je wzorem:
– stała podziału substancji
– stężenie substancji w fazie nieruchomej
– stężenie substancji w fazie ruchomej
Substancja, która ma większe powinowactwo z fazą nieruchomą, wolniej wędruje po płytce chromatograficznej. Jej chromatografia trwa dłużej, a otrzymane plamki są rozmazane. Odwrotnie jest w przypadku substancji z większym stężeniem w fazie – jej chromatografia trwa krócej, a plamki są wyraźne i nierozmyte. Analiza chromatograficzna ma duże zastosowanie do analiz próbek środowiskowych czy biologicznych. Próbki te są złożone, przez co nie jest możliwe bezpośrednie ich analizowanie. W celu analizy próbek złożonych (środowiskowych czy biologicznych), należy wykonać ekstrakcjęekstrakcję. Ekstrakcja wykorzystuje prawo Nernsta. Proces ekstrakcji polega na wyodrębnieniu interesującego nas składnika, wykorzystując jego różną rozpuszczalność między dwoma niemieszającymi się cieczami.
Jakie wyróżniamy typy chromatografii?
Podstawowy podział chromatografii zależy od fazy ruchomej. W chromatografii jest nią gaz, ciecz lub płyn, który przemieszcza się podczas tego procesu razem z substancjami oznaczanymi po płytce lub kolumnie chromatograficznej (fazie stacjonarnej – nieruchomej). W zależności od fazy ruchomej, wyróżniamy następujące typy chromatografii:
Chromatografię gazową (GC z ang. Gas Chromatography)
Fazą ruchomą jest gaz.
Chromatografię cieczową (LC z ang. Liquid Chromatography)
Fazą ruchomą jest ciecz.
Chromatografię nadkrytyczną (SFC z ang. Supercritical Fluid Chromatography)
Fazą ruchomą jest substancja w stanie nadkrytycznym, czyli takim, w którym dana substancja wykazuje właściwości pośrednie między gazem a cieczą.
Chromatografia cienkowarstwowa TLC (z angielskiego thin layer chromatography) i bibułowa są metodami chromatografii cieczowej lub planarnej, ponieważ proces rozdziału przeprowadzony jest na płaszczyźnie.
Chromatografia TLC
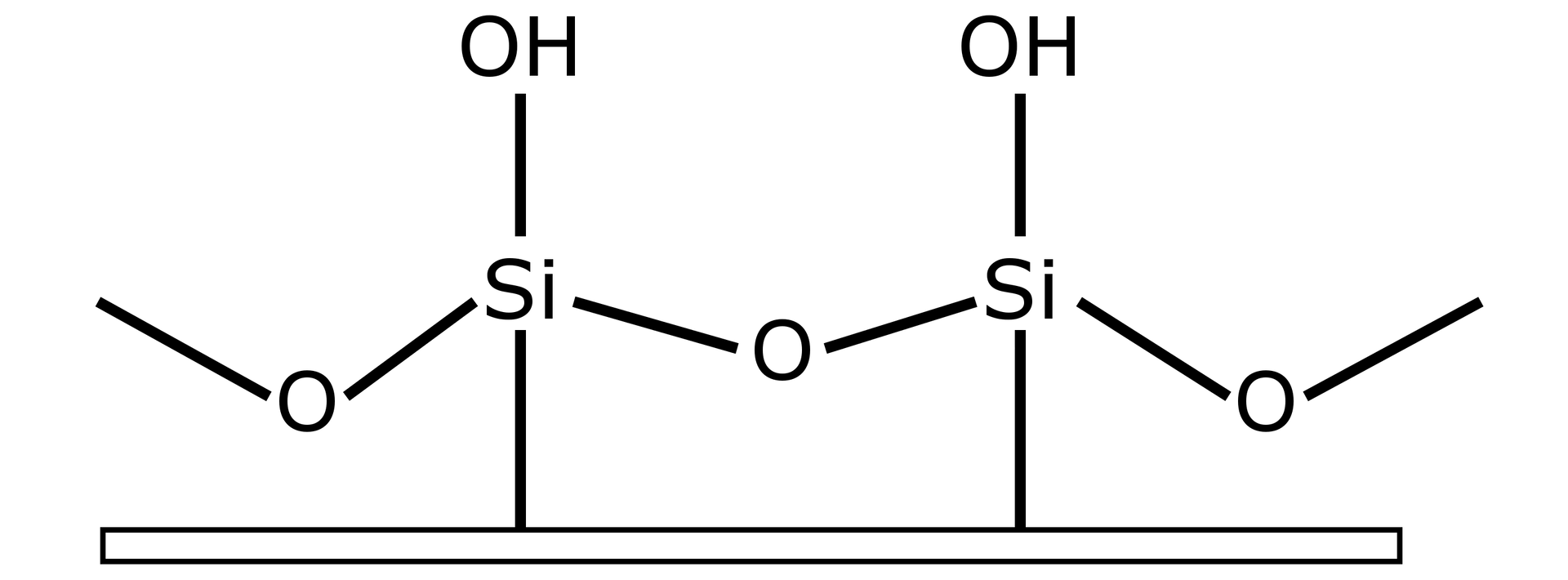
Chromatografię TLC przeprowadza się na płytkach aluminiowych pokrytych odpowiednim adsorbentem. AdsorbentAdsorbent jest substancją o bardzo dużej powierzchni, na której zachodzą wiązania różnych substancji. Wiązanie między fazą nieruchomą a związkiem może zachodzić przez m.in. wiązania wodorowewiązania wodorowe czy oddziaływania van der Waalsaoddziaływania van der Waalsa. Na co dzień masz do czynienia z adsorbentem w postaci węgla aktywnego. Stosuje się go podczas zatruć różnymi substancjami chemicznymi. W przypadku chromatografii TLC zazwyczaj używa się silikażelsilikażel, inaczej nazywany żelem krzemionkowym. Spotkasz go w woreczku umieszczonym w pudełku z nowymi butami w postaci białych kryształków silikażelu. Jak myślisz, jakie ma zastosowanie? Żel krzemionkowy jest polimerem kwasu krzemowego, a jego wzór można zapisać następująco: .
Po wybraniu odpowiedniej płytki, ostrożnie, nie dotykając powierzchni silikażelu palcem, na jej dole, co najmniej od początku płytki, rysujemy ołówkiem linię startu, a na niej zaznaczamy kropki ołówkiem z podpisem substancji. Następnie nanosimy kapilarą niewielką kroplę substancji, uważając, aby krople substancji nie zmieszały się ze sobą. Tak jak jest to przedstawione na rysunku:

Po sporządzeniu płytki z substancjami przygotowujemy komorę chromatograficzną. Jest nią nic innego jak zlewka, ale z pokrywą, która ją szczelnie zamyka. Na dno wlewamy trochę fazy ruchomej – eluentu – pamiętając o tym, że wysokość eluentu nie może być większa bądź równa niż wysokość linii startu.
Eluent wybieramy, korzystając z tzw. szeregu eluotropowego. Jest to uszeregowanie rozpuszczalników wg rosnącej mocy elucji na odpowiedniej fazie stacjonarnej, w tym przypadku silikażelu:
n–pentan (najsłabiej oddziałuje z fazą stacjonarną);
disiarczek węgla;
toluen (metylobenzen);
eter dietylowy;
chloroform;
–nitropropan;
aceton (propan––on);
metanol;
woda;
kwas octowy (etanowy) (najmocniej oddziałuje z fazą stacjonarną.
Czyli n–pentan wędruje najszybciej w górę płytki chromatograficznej, zaś kwas octowy porusza się po niej pomału. Można zaobserwować, że siła elucji rośnie wraz ze wzrostem polarności rozpuszczalnika.
Zamykamy komorę – wypełnia się ona parami eluentu. Proces ten nazywamy kondycjonowaniem komory chromatograficznej. Po upływie ok. możemy umieścić płytkę w komorze.

Po kondycjonowaniu komory wkładamy płytkę, zamykamy naczynie przykrywką i czekamy, aż eluent dotrze na górę płytki, zostawiając około przed górną krawędzią płytki.
Wyciągamy płytkę, zaznaczamy czoło chromatogramu ołówkiem i ją suszymy.
Po wysuszeniu płytki można czasami zauważyć, że z pojedynczej próbki naniesionej na linie startu, po rozwinięciu, widnieje kilka plamek – oznacza to nic innego, jak to, że nasza próbka była mieszaniną substancji. W zależności od ilości plamek, które pojawiły się między linią startu a linią czoła, możemy określić, ile różnych substancji jest w mieszaninie.
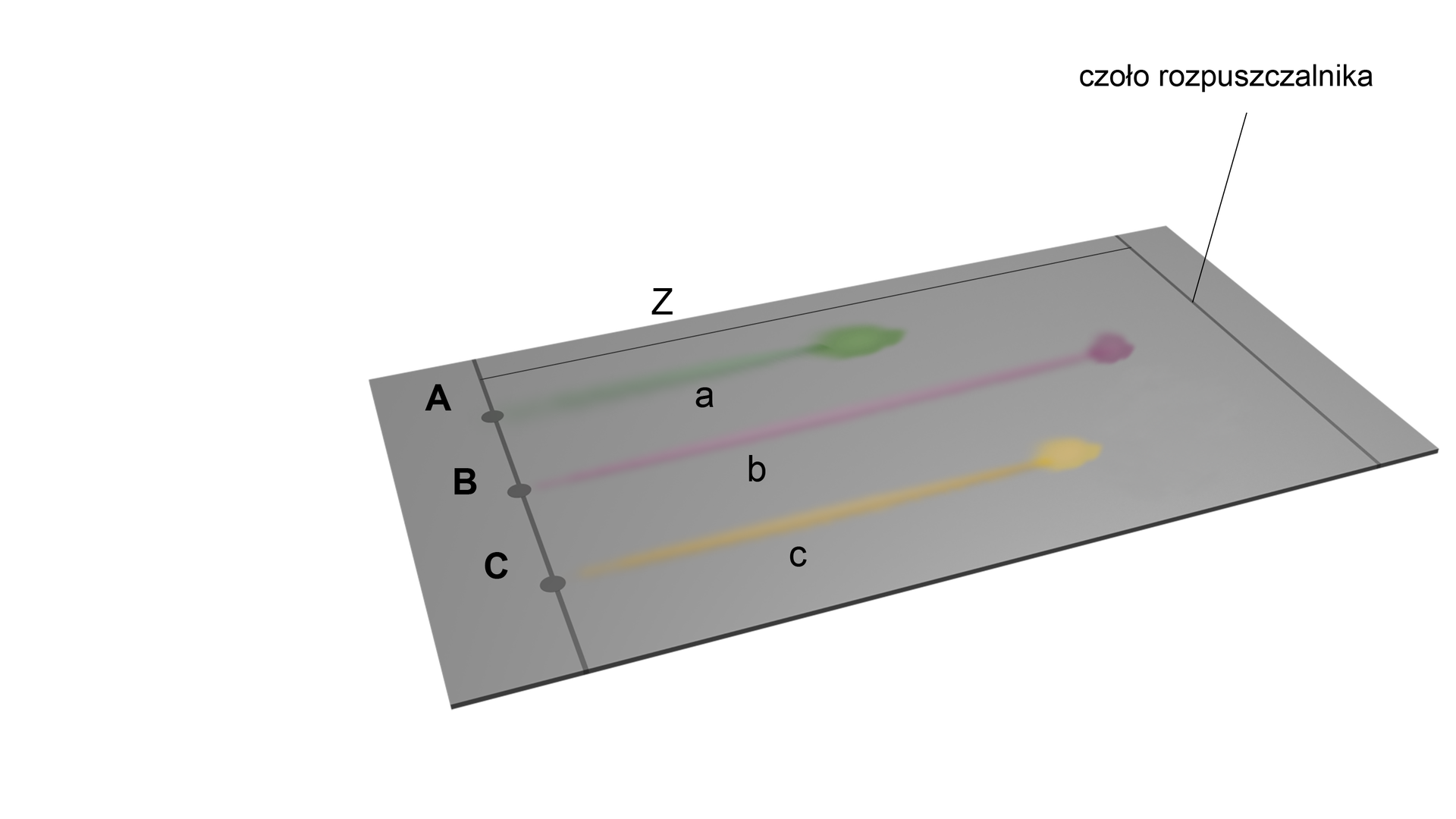
Ważnym parametrem chromatografii jest współczynnik retencji – jest to droga, jaką przebył związek na płytce w stosunku do czoła chromatografu. Możemy przedstawić to wzorem:
gdzie:
– przebyta odległość przez związek od linii startu;
– przebyta odległość przez rozpuszczalnik.
Dla związku A:
Czoło rozpuszczalnika znajduje się od linii startu, natomiast plamka związku znajduje się od linii startu, więc współczynnik retencji wynosi:
przyjmuje wartości od do . Im wartość jest mniejsza, tym związek silniej oddziałuje z fazą stacjonarną. Im jest większy, tym związek słabiej oddziałuje z fazą stacjonarną. Współczynnik jest stały dla danej substancji pod warunkiem, że jest chromatografowana takim samym eluentem – nawet niewielka zmiana warunków chromatografii może zmienić współczynnik retencji.
Możemy to porównać do zakupów w galerii handlowej: kierujesz się do wyjścia (podążasz z eluentem), patrzysz na boki i widzisz promocje, wchodzisz zatem do sklepu (oddziałujesz mocniej z fazą stacjonarną). Jednak im więcej sklepów odwiedzisz przed wyjściem, tym bardziej oddziałujesz z fazą stacjonarną i potrzebujesz więcej czasu, aby wydostać się z galerii.
Zamiast płytki TLC możemy użyć bibuły. Zasada działania jest taka sama.
Zastosowanie chromatografii TLC
Chromatografia TLC i bibułowa znajdują zastosowanie w:
wykrywaniu jonów metali;
barwników;
kontroli jakości;
monitorowaniu zanieczyszczeń środowiska.
- Nazwa kategorii: zastosowania[br]chromatografii[br]TLC i bibułowej
- Nazwa kategorii: wykrywanie jonów[br]metali
- Nazwa kategorii: wykrywanie[br]barwników
- Nazwa kategorii: kontrola jakości
- Nazwa kategorii: monitorowanie[br]zanieczyszczeń[br]środowiska Koniec elementów należących do kategorii zastosowania[br]chromatografii[br]TLC i bibułowej
- Elementy należące do kategorii zastosowania[br]chromatografii[br]TLC i bibułowej
Podsumowując, chromatografia dostarcza chemikowi dwie bardzo ważne informacje. Pierwszą z nich jest informacja jakościowa – zarówno liczba plamek, jak i sygnałów na chromatogramie określa nam ilość substancji w analizowanej próbce. Drugą informacją jest informacja ilościowa – zarówno wielkość plamki, jak i powierzchnia sygnału umożliwia nam obliczenie masy analitu w badanej próbce.
Słownik
substancja stała (krystaliczna lub żel), na powierzchni której zachodzi adsorpcja
(amin(a) + kwas) związki chemiczne występujące w organizmach żywych, które w swojej budowie zawierają grupę karboksylową () oraz grupę aminową
()
sacharydy (fr. saccharide); węglowodany polihydroksylowe; aldehydy (aldozy) lub ketony (ketozy) o wzorze sumarycznym , a także ich pochodne
(gr. chrṓma „barwa”, gráphō „piszę”) metoda rozdzielania jednorodnych mieszanin na składniki, w której wykorzystuje się różnicę sił oddziaływania tych składników z fazą ruchomą i nieruchomą (stacjonarną)
w danej temperaturze opisuje równowagę stosunku stężeń substancji między dwoma niemieszającymi się fazami
(ang. adsorption) proces wiązania się indywiduów chemicznych na powierzchni substancji chemicznej, np.: osadzanie się cząsteczek zanieczyszczeń na powierzchni węgla aktywnego
rozpuszczalnik, który wymywa substancje zaadsorbowane na fazie stałej
(łac. extractio „wyciągnięcie”, „wyjęcie”) techn. chemiczna metoda wyodrębniania określonych składników z mieszanin ciekłych lub stałych za pomocą odpowiednio dobranych, selektywnych rozpuszczalników (o różnej zdolności rozpuszczania poszczególnych składników lub określonych ich grup)
własność indywiduów chemicznych do występowania w nich nierównomiernego rozmieszczenia ładunku dodatniego i ujemnego
żel krzemionkowa; wysuszony żel produktów polikondensacji anionów krzemotlenowych, będący uwodnionym ditlenkiem krzemu
słabe dwuciałowe oddziaływania związane z kwantową naturą powłok elektronowych elektrycznie obojętnych atomów lub cząsteczek; oddziaływania związane z ruchem elektronów
rodzaj oddziaływania międzycząsteczkowego lub wewnątrzcząsteczkowego za pośrednictwem atomu wodoru
Bibliografia
Sherma J., Fried B., Handbook of Thin–Layer Chromatography, Third Edition, New York .
Witkiewicz Z., Kałużna–Czaplińska J., Podstawy chromatografii i technik elektromigracyjnych, Warszawa .